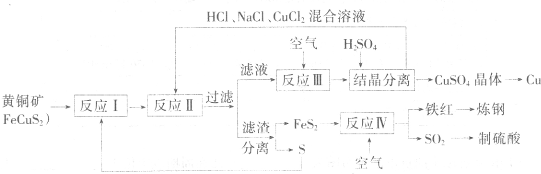
【化学-选修化学与技术】
海水中镁的总储量约为2.1×10
15 t,目前世界生产的镁60%来自海水.海水的综合利用可以制备金属镁,其流程如下图所示:

其步骤为:
①将海边大量存在的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
②将石灰乳加入到经过蒸发浓缩并滤去粗盐后的海水中,过滤得到Mg(OH)
2沉淀;
③向Mg(OH)
2沉淀中加入盐酸得到MgCl
2溶液,再经蒸发结晶得到MgCl
2?6H
2O;
④将MgCl
2?6H
2O在一定条件下加热得到无水MgCl
2;
⑤电解熔融的MgCl
2可得到Mg.
请回答下列问题:
(1)步骤①中煅烧贝壳时所发生反应的化学方程式为
.
(2)工业上采用电解MgCl
2的方法制得金属镁,电解槽中阴极的电极反应式为
.
(3)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有
、
、酒精灯、铁架台等.
(4)海水中的镁以Mg
2+的形式存在,设计步骤②③将Mg
2+转化为Mg(OH)
2,然后又重新转化为Mg
2+的目的是
.
(5)步骤④中的“一定条件”指的是
,目的是
.
(6)在上述制取镁的流程中,所涉及到的基本反应类型有
.
a.化和反应b.分解反应c.置换反应d.复分解反应
(7)由海水得到的粗盐中常含有Ca
2+、Mg
2+、SO
42-等杂质,为除去这些杂质可加入Na
2CO
3、NaOH和BaCl
2,然后过滤,则所加入试剂的合理顺序为
.




 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案