
| A. | K+、Cl-、NO3-、HCO3- | B. | K+、Fe2+、I-、NO3- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、AlO2-、Cl-、HS- |
分析 由水电离产生的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:由水电离产生的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液,
A.酸碱溶液中均不能大量存在HCO3-,不能共存,故A错误;
B.酸溶液中Fe2+(或I-)、NO3-发生氧化还原反应不能共存,碱溶液中不能大量存在Fe2+,故B错误;
C.酸、碱溶液中该组离子之间不反应,可大量共存,故C正确;
D.Al3+、AlO2-相互促进水解,不能大量共存,且酸溶液中不能大量存在AlO2-、HS-,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
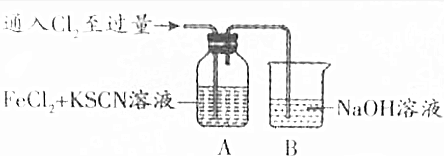 | Ⅰ.装置A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
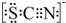
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
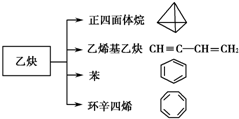 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. |  和 和 互为同系物 互为同系物 | |
| C. | Na2SO3和H2O2的反应为氧化还原反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
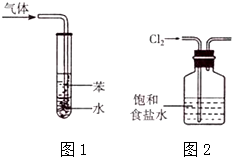
| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用量筒量取 20mL 0.5000mol•L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 图1所示装置可用于吸收NH3或HC1气体,并防止倒吸 | |
| D. | 实验室用图2所示装置除去Cl2中的少量HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铜溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com