
| A. | 将胆矾加热变成白色粉末 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | 干冰升华 | D. | 生石灰与水反应生成熟石灰 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.将胆矾加热变成白色粉末,即胆矾分解,是吸热反应,故A正确;
B.葡萄糖在人体内氧化分解为放热反应,故B错误;
C.干冰升华由固态变成气态为吸热过程,物理变化,故C错误;
D.生石灰跟水反应是放热反应,故D错误;
故选A.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将电石与水直接混合可以平稳快速制备乙炔 | |
| D. | CCl4加入盛碘水的分液漏斗中振荡、静置,从下口放出紫红色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题:
西南地区有较丰富的食盐矿和电力资源,适合建设大型的氯碱工业.下图是用惰性电极电解饱和食盐水的原理示意图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Z、Y、X的原子半径依次减小 | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用碳酸钠溶液吸收足量二氧化硫:2CO32-+2SO2+H2O═2HCO3-+SO32- | |
| D. | 在FeBr2溶液中通入足量的Cl2气体:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
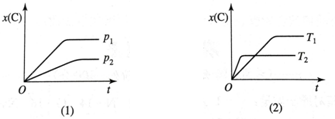
| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com