
【题目】常温下,将0.20mol/L H2X溶液与0.20mol/L NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如下图所示.下列说法错误的是( ) 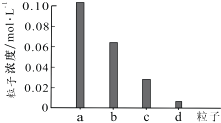
A.图中a代表Na+ , d代表H2X分子
B.H2X为二元弱酸,HX﹣的电离程度大于水解程度
C.混合溶液pH=3.6时:c(H+)+c(H2X)=c(X2﹣)+c(OH﹣)
D.继续滴加NaOH溶液至pH=7.0时:c(Na+)>c(HX﹣)+2c(X2﹣)
【答案】D
【解析】解:A、图中a的浓度大于0.1mol/L,代表Na+ , d的浓度小于0.01mol/L,代表H2X分子,故A正确;B、两者等体积恰好完全反应生成NaHX,溶液呈酸性,说明H2X为二元弱酸,HX﹣的电离程度大于水解程度,故B正确;
C、根据电荷守恒c(Na+)+c(H+)=c(HX﹣)+2c(X2﹣)+c(OH﹣)①,物料守恒可知:c(Na+)=c(HX﹣)+c(X2﹣)+C(H2X)②,②代入①得:c(H+)+C(H2X)=C(X2﹣)+c(OH﹣),故C正确;
D、根据电荷守恒c(Na+)+c(H+)=c(HX﹣)+2c(X2﹣)+c(OH﹣),继续滴加NaOH溶液至pH=7.0时c(H+)=c(OH﹣),即:c(Na+)=c(HX﹣)+2c(X2﹣),故D错误;
故选D.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA
C.1 mol﹣OH中电子数为10 NA
D.标准状况下,2.24 L CHCl3的原子总数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略,如加热等) 
已知以下信息:
①A属于芳香烃,H属于酯类化合物;②I的核磁共振氢谱为二组峰,且峰的面积比为6:1.
回答下列问题:
(1)B的结构简式 , D的官能团名称 .
(2)B→C的反应类型; D→E的反应类型 ,
(3)①C→D的化学方程式 . ②E+F→H的化学方程式 .
③I→G的化学方程式 .
④G→J的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金(含硅15.5%)在凝固时收缩率很小,因而这种合金适合铸造,现有下列3种晶体:①铝②硅③铝、硅合金,它们的熔点从低到高的顺序是( )
A.①②③
B.②①③
C.③②①
D.③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.冶炼铜的反应为8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2 .
8Cu+4FeO+2Fe2O3+16SO2 .
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号).
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在 Fe3+的方法是(注明试剂、现象).
(3)上述冶炼过程产生大量SO2 . 下列处理方案中合理的是(填代号) a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是 .
(5)实验室制备,收集干燥的SO2 , 所需仪器如下. 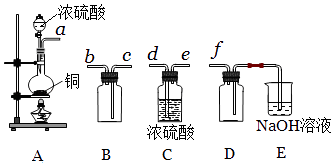
①其中装置A产生SO2 , 反应的化学方程式为 .
②请按气流方向连接各仪器接口,顺序为a→→→→f,
装置E中NaOH溶液的作用是 . E中反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(布洛芬)是临床常用的镇痛消炎药,其合成路线如下(部分反应条件和试剂略): 
已知:(1) ![]() (R1、R2代表烷基);(2)
(R1、R2代表烷基);(2) ![]() +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→ ![]() COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)
请回答下列问题:
(1)化合物H的分子式是 , 化合物B的官能团名称是 , 第③步的化学反应类型是
(2)第②步反应的化学方程式是 .
(3)化合物G的结构简式是 .
(4)第④步反应的化学方程式是 .
(5)同时满足下列条件的H的所有同分异构体的结构简式是 .
I.结构中有苯环,无﹣O﹣O﹣;II.核磁共振氢谱为4组峰,峰面积之比为2:2:1:1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与氢溴酸反应合成溴乙烷,其装置如下(夹持和加热装置略): 
【查阅资料】NaBr+H2SO4=NaHSO4+HBr
溴乙烷是无色液体,沸点38.4℃,密度1.44g/cm3 .
【合成反应】在a中加入20mL 95%的乙醇和20mL水,在搅拌、冷却下,缓慢加入40mL浓硫酸.再加入30g溴化钠和几粒碎瓷片,d中加入少量冰水并置于冰水浴e中.b中通入冷却水后,小火加热a,直到c处无油滴滴出,结束反应.
【分离提纯】将d中馏出液转入分液漏斗中,静置,将有机层转入另一锥形瓶并置于冰水浴中冷却;在振荡下向有机液中逐滴加入4mL浓硫酸,再用干燥的分液漏斗分去硫酸层.最后通过蒸馏得到纯净的溴乙烷.
请回答下列问题:
(1)冷凝管的进水口是(填字母编号).
(2)a中加入碎瓷片的作用是 . 锥形瓶置于冰水浴中冷却降温的原因是 . 如果d中的馏出液略带橙红色,其中橙红色的物质可用足量饱和NaHSO3溶液洗涤除去,有关反应的离子方程式是 .
(3)本实验的有机副产物可能有(写出其中两种的结构简式).
(4)在第一次分离过程中,有机层从分液漏斗(填“上口倒出”或“下口放出”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中一定含有金属元素
B. 构成物质的分子中一定含有化学键
C. 非极性键也可能存在于离子化合物中
D. 共价化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良.铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如图1: 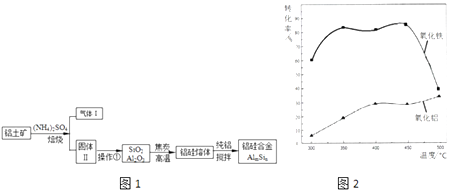
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性.原因是 .
(2)焙烧除铁反应时Fe2O3转化为NH4Fe(SO4)2 , Al2O3少部分发生类似反应,写出Fe2O3发生反应的方程式 . 氧化物转化为硫酸盐的百分率与温度的关系如图2,最适宜焙烧温度为 .
(3)若操作①中所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 .
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体.写出中间体SiC再与Al2O3反应生成铝、硅单质的化学方程式 .
(5)不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:n= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com