
 云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:
云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:分析 (1)Ni元素原子核外电子数为28,结合能量最低原理书写核外电子排布式;
(2)①SO42-中S原子的孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=4;
②[Ni(NH3)6]SO4阳离子中提供空轨道的粒子是Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键;
③N原子2p能级半充满的稳定结构;
(3)①根据均摊法计算晶胞中Ni、Cu原子数目;
②该晶胞中面上的两个Au原子和一个Cu原子紧密相邻,棱上的两个Au原子距离最近,距离最近的两个Au原子核间距=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$,所以该晶胞中距离最近的两个Cu原子的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$.
解答 解:(1)Ni元素原子核外电子数为28,核外电子排布式为:1s22s22p63s23p63d84s2,3d能级上的未成对电子数为2,
故答案为:1s22s22p63s23p63d84s2;2;
(2)①SO42-中S原子的孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=4,所以中心原子的杂化类型是sp3,
故答案为:sp3;
②[Ni(NH3)6]SO4阳离子中提供空轨道的粒子是Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键,故答案为:Ni2+;
③N原子2p能级半充满的稳定结构,所以N原子的第一电离能大于O原子的第一电离能,故答案为:>;N原子2p能级半充满;
(3)①晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×$\frac{1}{8}$=1、Cu原子数目=6×$\frac{1}{2}$=3,故晶胞中镍原子与铜原子的数量比为1:3,
故答案为:1:3;
②该晶胞中面上的两个Au原子和一个Cu原子紧密相邻,棱上的两个Au原子距离最近,距离最近的两个Au原子核间距=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$=$\root{3}{\frac{64×3+197}{d{N}_{A}}}$cm,所以所以该晶胞中距离最近的两个Cu原子的距离为$\frac{\sqrt{2}}{2}$$\root{3}{\frac{64×3+197}{d{N}_{A}}}$×$1{0}^{-{7}^{\;}}$nm,故答案为:$\frac{\sqrt{2}}{2}$$\root{3}{\frac{64×3+197}{d{N}_{A}}}$×$1{0}^{-{7}^{\;}}$.
点评 本题考查物质结构和性质,涉及核外电子排布、空间构型与杂化方式判断、配位键、电离能、晶胞计算等,注意对基础知识的理解掌握,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题

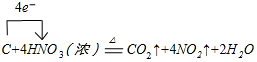 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原产物为NH4+ | |
| B. | 若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ | |
| C. | Fe3+和Fe2+分别属于反应物和生成物 | |
| D. | 氧化剂与还原剂的物质的量之比为1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2具有氧化性,在反应中只做氧化剂 | |
| B. | 1735Cl、1737Cl为不同的核素,但化学性质几乎完全相同 | |
| C. | 实验室用加热NH4Cl固体的方法来制备NH3 | |
| D. | 1.12L Cl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
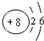 和
和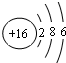 下列叙述正确的是( )
下列叙述正确的是( )| A. | A、B处于同一周期 | B. | A的非金属性比B弱 | ||
| C. | A的最高化合价等于B的最高化合价 | D. | A、B同处于VIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com