
| A. | 质子数与中子数均为20的钙原子:2040Ca | |
| B. | 氮分子的电子式::N:::N: | |
| C. | 氯离子(Cl-)的结构示意图: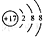 | |
| D. | 聚乙炔的结构简式: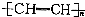 |
分析 A.根据原子符号的含义以及质量数=质子数+中子数;
B.氮气分子中的氮氮键为氮氮三键,注意氮氮三键的表示方法;
C.氯离子(Cl-)带一个单位负电荷,即得到一个电子形成的;
D.乙炔发生加聚反应,碳碳三键断裂,形成碳碳双键,形成聚乙炔.
解答 解:A.质子数与中子数均为20,则质量数为40,原子可表示为:2040Ca,故A正确;
B.氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为 ,故B错误;
,故B错误;
C.氯原子得1个电子后形成氯离子(Cl-),即最外层电子数由7个变成8个,其它不变,故C正确;
D.乙炔分子中C≡C三键中1个π键断裂,自身加聚生成聚乙炔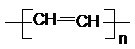
故选B.
点评 本题考查了原子符号、电子式、结构式、原子结构示意图的书写,题目难度中等,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
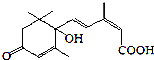
| A. | 该物质的分子式为C15H22O4 | |
| B. | 该物质环上的二氯代物共有3种 | |
| C. | 1mol该物质最多能与2 mol NaOH完全反应 | |
| D. | 该物质能发生取代、加成、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
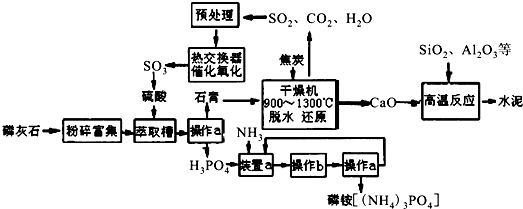
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
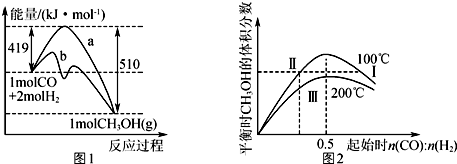
| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
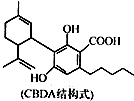
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
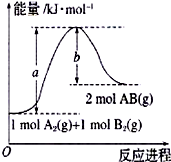 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
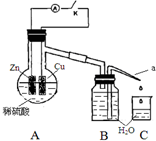 该同学用如下装置进行实验,分析影响反应速率的因素.
该同学用如下装置进行实验,分析影响反应速率的因素.| 实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
| 实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
| A. | 实验Ⅰ中化学能主要转化为热能 | |
| B. | 实验Ⅱ中化学能主要转化为电能 | |
| C. | 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率 | |
| D. | 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com