
实验室融化NaOH固体,不能选用的坩埚是( )
| A.铁坩埚 | B.石墨坩埚 | C.石英坩埚 | D.氧化铝坩埚 |
科目:高中化学 来源: 题型:单选题
下列关于实验原理或操作的叙述中,不正确的是
| A.判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| B.减压过滤不宜过滤胶状沉淀或颗粒太小的沉淀 |
| C.制备硫酸亚铁铵晶体,需加热至大量晶体析出并剩余少量液体即停止加热 |
| D.易燃试剂与强氧化性试剂需分开放置,并远离火源;金属着火时.可用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列实验的叙述中正确的是
| A.溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B.在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C.实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D.用电石和水可制得纯净的乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是 。
在灼烧操作中用到下列仪器中的一种,其名称是 。
(2)写出步骤①中发生反应的离子方程式 。
(3)操作③中的洗涤操作如何进行? 。
(4)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理? 。若合理,请用离子方程式解释其原因 (若你认为不合理,该空不作答)。
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题。请帮助丙同学画出该装置图,并注明试剂名称。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室欲配制100 mL、1mol/L的NaCl溶液,请回答:
(1)不需要使用的仪器是 。
A、烧杯B、500 mL容量瓶C、量筒 D、胶头滴管 E、玻璃棒 F、100 mL容量瓶
(2)配制时用托盘天平应称取NaCl g。
(3)配制溶液的操作顺序是(用字母表示) 。
A、称量 B、洗涤 C、定容 D、溶解 E、摇匀 F、转移
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O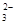 =2I-+S4O
=2I-+S4O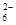 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com