
| A.原子最外层电子数为2的元素一定处于周期表的第IIA族 |
| B.构成单质的分子中一定含有共价键 |
| C.同主族元素形成的氧化物的晶体类型均相同 |
| D.金属与非金属元素形成的化合物可能是离子化合物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 键 mol。
键 mol。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常状况下是一种液体,且其中T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表的第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
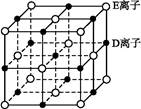
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
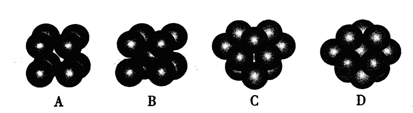
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1) 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性, 的分子构型是__________,
的分子构型是__________, 中Xe原子的杂化类型是_______,与
中Xe原子的杂化类型是_______,与 分子互为等电子体的离子有___________(填一种)。
分子互为等电子体的离子有___________(填一种)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.SO2 | B.BeCl2 | C.BBr3 | D.COCl2 |
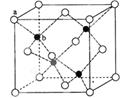
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.第一电离能由大到小的顺序为O>N>C |
B.由于C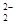 和O 和O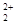 互为等电子体,所以可以推断O 互为等电子体,所以可以推断O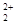 的电子式为 的电子式为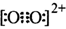 |
| C.根据岩浆晶出规则,Ca0比Mg0更容易在岩浆冷却过程中先结晶 |
| D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
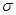 键。
键。 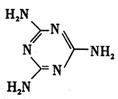

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com