
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答:
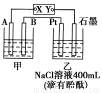
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。
(1)正 2Cl--2e-=Cl2↑
(2)4.48 L 0.4
(3)1 mol·L-1
【解析】(1)由题意得X极为正极,Pt电极为电解池的阳极,电极反应式为2Cl--2e-=Cl2↑。
(2)甲池的阴极电极反应式:Cu2++2e-=Cu。
乙池的阴极电极反应式:2H++2e-=H2↑由电子守恒得:
Cu ~ 2e- ~ H2
64 g 2 mol 22.4 L
12.8 g n(e-) V(H2)
则:n(e-)=0.4 mol V(H2)=4.48 L
(3)乙池发生反应:
2Cl-+2H2O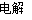 2OH- +H2↑ + Cl2↑
2OH- +H2↑ + Cl2↑
2 22.4 L
n(OH-) 4.48 L
n(OH-)=0.4 mol
电解后所得溶液c(OH-)=1 mol·L-1


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:选择题
下列对于25℃时pH为12的氨水,叙述正确的是( )
A.由水电离出的c(OH-)=1.0×10-2mol·L-1
B.c(NH4+)+c(NH3·H2O)=1.0×10-12mol·L-1
C.与等体积、pH=2的盐酸混合后所得的溶液中:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
D.加入一定量pH=2的醋酸溶液混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是( )
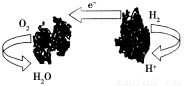
A.该电池工作过程中,H+浓度不断增大
B.该电池在高温环境下能提供更好的动力
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、
Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、AlO2-、NO3-、SO42-、CO32-。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A________;D________;E________;F________。
(2)用离子方程式解释C溶液呈碱性的原因:__________________________________。
(3)写出实验③中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为(提示:①H2C2O4是二元弱酸;②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O)
A.0.008889 B.0.0800 C.0.1200 D.0.2400
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:选择题
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。
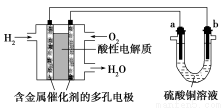
A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:选择题
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:填空题
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
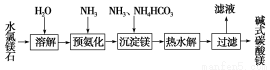
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:填空题
炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式: 。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为 。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO32-和N2,其离子方程式为 。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com