
分析 (1)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,由方程式可知,当有0.1mol KMnO4参加反应时,反应中HCl既表现为酸性,也表现出还原性,结合化合价的变化判断被氧化的盐酸的物质的量;
(2)根据方程式结合高锰酸钾和氯气的量之间的关系进行计算.
解答 解:(1)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,由方程式可知,当有0.1molKMnO4参加反应时,消耗盐酸是0.8mol,但是做还原剂的盐酸是参加反应的盐酸的物质的量的一半,所以被氧化的盐酸是0.4mol,质量是0.4mol×36.5g/mol=18.25g,答:参加反应的盐酸的物质的量是0.8mol,有18.25克HCl被氧化.
(2)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,由方程式可知,当有0.1molKMnO4参加反应时,有0.25mol Cl2生成,V(Cl2)=0.25mol×22.4L/mol=5.6L,
答:产生的Cl2在标准状况下的体积为5.6L.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意反应中盐酸既表现为还原性也表现酸性的特点,根据元素的化合价的变化计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol MgCl2 | |
| B. | Cl-浓度为2 mol•L-1 | |
| C. | 溶液中含有1 mol MgCl2 | |
| D. | 将95 g MgCl2溶于1 L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
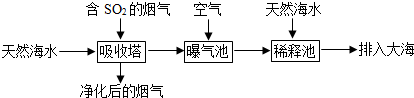
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ③①④②⑤ | D. | ⑤④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶吸附能力很强,常用作袋装食品、瓶装药品的干燥剂 | |
| B. | 氧化铝熔点很高,可用来制作耐火坩埚及耐高温实验仪器 | |
| C. | 二氧化硫能使品红溶液褪色,将氯气通入二氧化硫的饱和溶液中可增强其漂白性 | |
| D. | 硅导电性介于导体和绝缘体之间,是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 牙膏品牌 | 两面针儿童牙膏 | 珍珠防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | 1molSO2中含氧原子数约为6.02×1023 | |
| C. | 常温常压下,1molSO2的体积为22.4L | |
| D. | 常温常压下,64gSO2的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有共价键的物质都是共价化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 凡是在水溶液中能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中一定没有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com