
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题: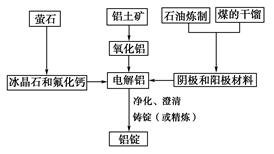
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
_________________________________________________________________。
(1)Al2O3(2分);石墨(或碳)(2分)
(2)加入冰晶石(Na3AlF6)和少量CaF2(2分)
(3)2C+O2 2CO (3分)
2CO (3分)
(4)MgCl2(熔融) Mg + Cl2↑(3分)(要注明“电解”条件)熔点太高,MgCl2熔点低,熔化时能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离(3分)
Mg + Cl2↑(3分)(要注明“电解”条件)熔点太高,MgCl2熔点低,熔化时能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离(3分)
解析试题分析:(1)铝土矿的主要化学成分是Al2O3,另外还有SiO2,Fe2O3、TiO2、H2O等,电解前必修进行提纯;石油炼制和煤的干馏的固体物质成分是碳,具有导电性,可以作为阳极和阴极材料。(2)纯净的Al2O3熔点非常高,而其电解必修是在其熔融状态下进行,若采用纯净的Al2O3进行电解,则加热熔融需要消耗大量的能量,所以工业上采取加入冰晶石(Na3AlF6)和少量氟化钙(CaF2)的方法降低熔点。(3)工业炼铝的关键技术是电解,电解时阳极发生氧化反应,O2-失电子变成O2,在电解过程中阳极材料碳会逐渐与氧气发生反应转变成CO。即化学方程式为:2C+O2 2CO。(4)MgCl2是离子化合物,熔融时能发生电离,AlCl3是共价化合物,熔融时不发生电离,再者氧化镁熔点很高,耗能太大。MgCl2的电解方程式为:MgCl2(熔融)
2CO。(4)MgCl2是离子化合物,熔融时能发生电离,AlCl3是共价化合物,熔融时不发生电离,再者氧化镁熔点很高,耗能太大。MgCl2的电解方程式为:MgCl2(熔融) Mg + Cl2↑
Mg + Cl2↑
考点:该题以工业炼铝为载体考查原料的判断、原理的诠释以及能量的合理利用。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:单选题
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铁;(Ⅳ)从氯化镁中炼镁,对它们的冶炼方法的分析不正确的是( )
| A.(I)用① | B.(Ⅱ)用② | C.(Ⅲ)用③ | D.(Ⅳ)用④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下,钛不和非金属、强酸反应;红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一称金红石(TiO2)目前大规模生产钛的方法是:
第一步:金红石、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式是______________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)此反应的化学方程式是__________________。
(2)简述由上述所得产物中获取金属钛的步骤______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ下列说法不正确的是____ 。
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是 ,目的是除去铁矿石中的脉石,其产物密度比铁 ,所以在铁水的 (填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是 。
| A.作为燃料,为炼铁中的化学反应反应(删去)提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.作为熔剂,除去铁矿石中的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下: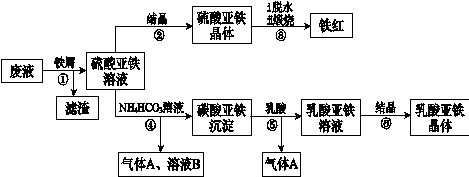
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等。制备流程如图所示:
(1)滤渣的成分是______(填化学式);滤液Ⅱ中所含的主要杂质离子 (写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为________;加入NaClO还能起到的作用是______。
(3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是_____。用MgCl2·6H2O制备无水MgCl2过程中,所需要的化学试剂是________。
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_________________________________。SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com