
| A、BaSO4在饱和Na2SO4溶液中的溶解度与Ksp均比在纯水中的小 |
| B、若将0.01molNaOH溶于1L水,则溶液中由水电离产生的c(H+)=1×10-12mol?L-1 |
| C、10ml0.5mol?L-1CH3COONa溶液与6ml1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| D、pH=4的HA与pH=10的BOH溶液等体积混合,所得溶液pH=7,则HA、BOH一定为强酸和强碱 |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
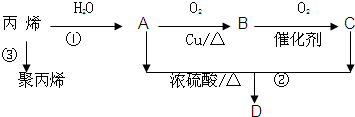
查看答案和解析>>
科目:高中化学 来源: 题型:
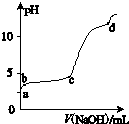 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
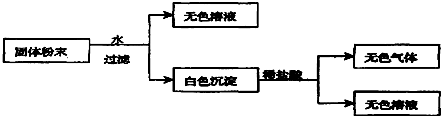
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 |
| n(PCl5) | 4 | 2.8 | 2 | 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
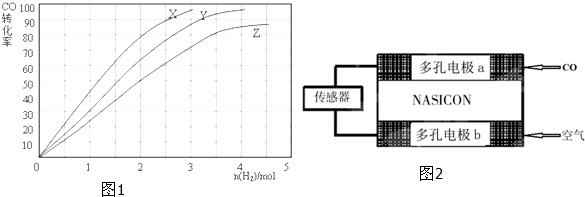
查看答案和解析>>
科目:高中化学 来源: 题型:
 用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 新制氯水 | PH试纸 | 变白 | 氯气具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气显碱性 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,浓硝酸 | KI淀粉试纸 | 变蓝 | NO2为酸性气体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com