
【题目】氢氧燃料电池,是一种高效无污染的清洁电池,它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,下图是氢氧燃料电池。
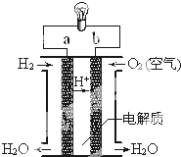
(1)该电池的负极是通_____(填通入的气体)。
(2)如果是碱性燃料电池则负极反应方程式是:___________。
(3)如果是酸性燃料电池则正极极反应方程式是:__________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.在溴化铁存在的条件下,苯与溴水发生反应生成褐色的液体溴苯
B.在试管中依次加入一定量的浓硫酸、浓硝酸和苯,然后加热制取硝基苯
C.除去乙烷中混有的少量乙烯的方法是将其通入溴水中
D.等物质的量的甲烷与氯气在光照条件下反应可以得到纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中三次使用的仪器X的名称为__________________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列_______(填字母)代。
![]()
![]()
![]()
a.空气冷凝管 b.直形冷凝管 c.蛇形冷凝管
(2)实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为_______(填字母)。
a.活性炭 b.碱石灰 c.P2O5 d.浓硫酸
无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________________________。
(3)实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_______。当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。索氏提取法与一般萃取法相比较,其优点为___________________________。
(4)数据处理:样品中纯脂肪百分含量_________(填“<”、“>”或“=”)(b-c)/(b-a)×100%;测定中的样品、装置、乙醚都需要进行脱水处理,否则导致测定结果__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
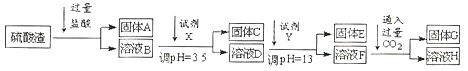
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
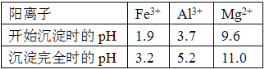
(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 水加热到很高温度都难分解是因水分子间存在氢键
B. C2H2分子中σ键与π键的数目比为1∶1
C. CS2为V形极性分子
D. SiF4与SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g质量分数为46%的乙醇水溶液中含有氧原子数为4NA
B. 若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C. 向大量水中通入1 mol氯气,反应中转移的电子数为NA
D. 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com