
在混合体系中,确认化学反应先后顺序有利于问题解决,下列反应顺序判断正确的是
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2可以看成:
KOH、Ba(OH)2、BaCO3、K2CO3
D.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:
AlO2-、Al(OH)3、OH-、CO32-
科目:高中化学 来源: 题型:
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.V(A) = 0.7mol·L-1·min-1 B.V(B) = 0.3mol·L-1·min-1
C.V(C) = 0.9mol·L-1·min-1 D.V(D) = 1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为 CH2=CHCH2CH CH2OH,下列叙述不正确的是
COOH
A.1mol该有机物能与足量金属钠反应放出1molH2
B.能与乙醇发生酯化反应
C.1mol该有机物在催化剂作用下最多能与1molH2发生还原反应
D.1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.甲基橙变红的溶液中可能大量存在Na+、ClO-、SO42-、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知它的熔点为150℃,燃烧热极高。下列说法肯定错误的是
A.Al2H6在固态时所形成的晶体是分子晶体 B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物可能成为未来的储氢材料和火箭燃料
D.氢铝化合物组成也可表达为AlnH2n+2的物质(n为正整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生话中应用广泛,用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,该反应的化学方程式为
▲ ,反应中消耗1mol的H2C2O4时转移电子数为 ▲
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 ▲ mol
(3)写出Na2S与FeCl3溶液混合的离子方程式_________________▲________________
查看答案和解析>>
科目:高中化学 来源: 题型:
一种比黄金还要贵重百倍的 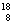 O2 气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种
O2 气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种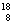 O2 气体所含有的中子的物质的量为
O2 气体所含有的中子的物质的量为
A.36 mol B.20 mol C.16 mol D.20 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,
C的元素名称为 ,
D的单质与水反应的离子方程式为_ 。
(3)写出D、E两元素最高价氧化物的水化物溶液反应的化学方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性 B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液小心低温蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com