
��12�֣� �跴Ӧ��![]() ��ƽ�ⳣ��Ϊ
��ƽ�ⳣ��Ϊ![]() ����Ӧ��
����Ӧ��![]() ��ƽ�ⳣ��Ϊ
��ƽ�ⳣ��Ϊ![]() ���ڲ�ͬ�¶��£�
���ڲ�ͬ�¶��£�![]() ��
��![]() ��ֵ���£�
��ֵ���£�
| �¶� |
|
|
|
| 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)���ϱ������ƶϣ���Ӧ����_______________ (����������š�)�ȷ�Ӧ��
(2)���з�Ӧ��![]() д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����
д���÷�Ӧ��ƽ�ⳣ��K3����ѧ����
ʽ��K![]() =____________��
=____________��
(3)���ݷ�Ӧ����ڣ����Ƶ���K![]() ��K
��K![]() ��K
��K![]() ֮��Ĺ�ϵʽ_______________����
֮��Ĺ�ϵʽ_______________����
![]() �˹�ϵʽ���ϱ����ݣ�Ҳ���ƶϳ���Ӧ���ǡ����ȡ����ǡ����ȡ���Ӧ���ʣ�Ҫʹ��Ӧ
�˹�ϵʽ���ϱ����ݣ�Ҳ���ƶϳ���Ӧ���ǡ����ȡ����ǡ����ȡ���Ӧ���ʣ�Ҫʹ��Ӧ
����һ�������½�����ƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��___________________
(����)��
A����С��Ӧ�����ݻ� B������Ӧ�����ݻ� C�������¶�
D�������¶� E��ʹ�ú��ʵĴ��� F���跨����CO����
(4)ͼl��2��ʾ�÷�Ӧ����ʱ��t![]() �ﵽƽ�⡢��ʱ��t
�ﵽƽ�⡢��ʱ��t![]() �ֱ���ı�ij�������������仯��
�ֱ���ı�ij�������������仯��
�����
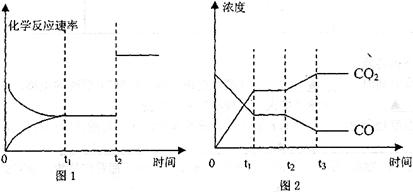
��ͼl��ʱ��t![]() �����ı��������________________________________________
�����ı��������________________________________________
��ͼ2��ʱ��t![]() �����ı��������________________________________________
�����ı��������________________________________________
 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| c2(OH-) |
| c(SO42-) |
| c2(OH-) |
| c(SO42-) |
| SO | 2- 4 |
| b-0.01 |
| b |
| b-0.01 |
| b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������ѧ֪ʶ������������⣺
��������ѧ֪ʶ������������⣺ H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��| �¶�/��C | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| T��K�� | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com