
| A. | Mg2+、Fe3+、Cl-、OH- | B. | Ba2+、HCO3-、Cl-、Na+ | ||
| C. | Fe2+、SO42-、H+、NO3- | D. | K+、NH4+、SO42-、OH- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 能导电的物质叫电解质 | |
| B. | NaCl晶体不导电,所以NaCl不是电解质 | |
| C. | 熔融的KOH导电,所以KOH是电解质 | |
| D. | 电解质在通电时发生电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
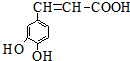
| A. | 与该芳香族化合物分子式相同、官能团种类及数目均相同且苯环上的一氯代物只有两种的有机物的结构有4种(不考虑空间异构) | |
| B. | 咖啡酸只能加聚成高分子化合物 | |
| C. | 咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 1mol该物质与足量的Na2CO3溶液反应,能消耗3 mol CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3易溶于水 | B. | 液态的FeCl3不导电 | ||
| C. | FeCl3常温下不易分解 | D. | FeCl3溶于水能电离,呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按F、Cl、Br、I的顺序,卤素单质的熔沸点相应升高 | |
| B. | 烷烃随碳原子数目增加,熔沸点相应升高 | |
| C. | 冰的密度低于液态水的密度,冰会浮在水面上 | |
| D. | 按O、S、Se、Te的顺序,氧族元素的气态氢化物稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4的酸性比HNO3弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒(Se)化氢比硫化氢稳定 | D. | 氢氧化钡比氢氧化钙的碱性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com