
分析 所得溶液的pH值为1,溶液中氢离子浓度为1×10-1mol•L-1,说明氢离子过量,根据题中稀硫酸和氢氧化钠溶液体积列式计算出V1:V2的比值.
解答 解:溶液中氢氧化钠的物质的量为:V2×10-3L×0.1mol/L=V2×10-4mol,
稀硫酸的物质的量为:V1×10-3L×0.15mol/L×2=3V1×10-4mol,
两溶液混合后溶液显示酸性,常温下pH=1的溶液中氢离子浓度为1×10-1mol•L-1,
则:3V1×10-4mol-V2×10-4mol=(V1+V2)×10-3L×1×10-1mol•L-1=(V1+V2)×10-4mol,
解得:V1:V2=1:1,
故答案为:1:1.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
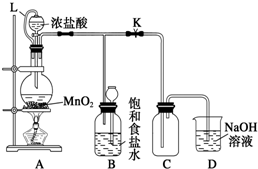
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
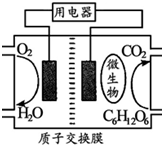 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁矿石在高温下被氧化成铁 | B. | 生铁中杂质被氧化 | ||
| C. | 铁矿石在高温下被焦炭还原成铁 | D. | 铁矿石在高温下被CO还原成铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com