
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 5 mol/L | D. | 1 mol/L |
分析 溶液稀释前后溶质的物质的量不变,则稀释后盐酸物质的量浓度=$\frac{5mol/L×0.01L}{0.1L}$=0.5mol/L,溶液具有均一稳定性,所以稀释后溶液中盐酸浓度都是相同的,与溶液体积大小无关,据此分析解答.
解答 解:溶液稀释前后溶质的物质的量不变,则稀释后盐酸物质的量浓度=$\frac{5mol/L×0.01L}{0.1L}$=0.5mol/L,溶液具有均一稳定性,所以稀释后溶液中盐酸浓度都是相同的,与溶液体积大小无关,所以5mL溶液物质的量浓度为0.5mol/L,故选A.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析计算能力,注意溶液均一性特点是解本题关键,为易错题.


科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
下列关于胶体的叙述中正确的是
A.氯化钠分散到酒精中,形成的分散系不是胶体
B.胶体区别于其他分散系的本质特征是丁达尔效应
C.胶体带电荷,而溶液呈电中性
D.由于土壤胶粒带负电,因此NH4+的肥效比NO3一高
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,电解槽底部的阳极泥中只有Cu和Pt | |
| D. | 电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 | |
| B. | 包装食品里常有硅胶、生石灰、还原铁粉三类小包,其作用相同 | |
| C. | 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同 | |
| D. | 家中做卫生保洁时,不可将“84”消毒液与洁厕精(含浓盐酸)混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
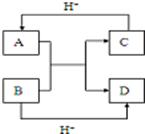 已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.
已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
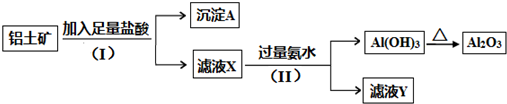
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| B. | 32g甲醇中存在的共价键总数是6 NA | |
| C. | 1L 0.1mol•L-1的NaHCO3溶液中氧原子数为0.3NA | |
| D. | 235g核素92235U中的中子数为92 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com