
(10分)在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性 。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH
B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
科目:高中化学 来源:2010年浙江省杭州地区七校联考高二第二学期期中化学试卷 题型:填空题
(10分)在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第一次高考模拟考试理综化学试卷(解析版) 题型:填空题
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g)  CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。?
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。?
时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+  O2 (g)
O2 (g)  CO2(g) + 2H2 (g)? ?H1= —192.9kJ/mol?
CO2(g) + 2H2 (g)? ?H1= —192.9kJ/mol?
H2(g)+  O2 (g)
O2 (g)  H2 O(g)? ?H2= —120.9kJ/mol?
H2 O(g)? ?H2= —120.9kJ/mol?
则甲醇与水蒸气催化重整反应的焓变△H3=_____??????????????????? 。?
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。?
③该反应的平衡常数表达式为K=__________________。?
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。?
A.加入催化剂?????????????? B.恒容充入He(g),使体系压强增大?
C.将H2(g)从体系中分离??? D.再充入1molH2O?
(2)甲醇在催化剂条件下可以直接氧化成甲酸。?
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。?
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)?
查看答案和解析>>
科目:高中化学 来源:2010年浙江省杭州地区七校联考高二第二学期期中化学试卷 题型:填空题
(10分)在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:

经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性 。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH
B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:
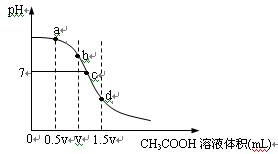
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性 。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH
B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com