
分析 两溶液所含离子各不相同,甲溶液里的阳离子只有两种,由H+、NH4+、Fe3+、A13+均能与OH-反应,则甲中的阳离子只能为K+、Na+;则乙中的阳离子为H+、NH4+、Fe3+、A13+,与乙中阳离子反应的阴离子应在甲中,剩余的阴离子在乙中,以此进行解答.
解答 解:由溶液中离子之间的反应可知,Al3+、Fe3+、NH4+、H+与OH-不能大量共存,且甲溶液里的阳离子只有两种,所以Al3+、Fe3+、NH4+、H+在乙溶液中,OH-在甲溶液中,由此知甲溶液呈碱性,乙溶液呈酸性,
乙溶液呈酸性,能和酸反应的离子AlO2-、CO32-、S2-不能在乙溶液中,只能在甲溶液中,高锰酸根离子有强氧化性,不能和氯离子、硫离子共存,所以氯离子和硫离子存在于甲溶液中,甲溶液里的阳离子只有两种,Na+、K+在甲溶液中,甲、乙两溶液各含14种离子中的7种,所以NO3-(或Cl-)、SO42-在乙溶液中,
由以上分析知,甲溶液中存在的离子为:Cl-(或NO3-)、Na+、K+、OH-、S2-、AlO2-、CO32-,
乙溶液中存在的离子为:Al3+、NO3-(或Cl-)、MnO4-、Fe3+、NH4+、SO42-、H+,
所以甲溶液中的阳离子为:Na+、K+;乙溶液中的阴离子为:NO3-、MnO4-、SO42-或MnO4-、SO42-、Cl-,
故答案为:Na+、K+;NO3-、MnO4-、SO42-或MnO4-、SO42-、Cl-.
点评 本题考查离子的共存问题,题目难度中等,注意能与氢氧根离子反应的阳离子有四种是解答本题的突破口,熟悉离子的性质及检验方法为解答关键.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题

 ,BN中B元素的化合价为+3;
,BN中B元素的化合价为+3; ,其二氯代物有4种.
,其二氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4都属于极性键的非极性分子 | |
| B. | C、N、O、F 电负性依次减小 | |
| C. | 基态铜(Cu)原子的电子排布式为[Ar]3d94s2 | |
| D. | 价电子构型为3s23p4的粒子其电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
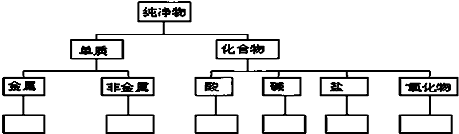
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
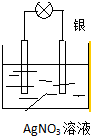 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4Z | B. | 4Z+10 | C. | 4Z+14 | D. | 4Z+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④⑤ | C. | ⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
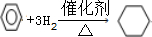
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com