
分析 (1)根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
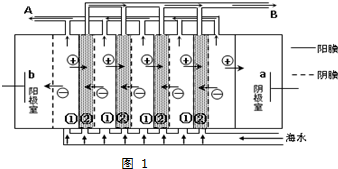
(2)①阴离子交换膜只允许阴离子通过,阳离子交换膜只允许阳离子通过,在电渗析法淡化海水示意图中离子浓度减小为淡化,反之为浓缩;
②海水中含有的Mg2+和Ca2+等阳离子易和氢氧根离子反应生成沉淀;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,离子浓度大的为浓水,离子浓度小的为淡水;
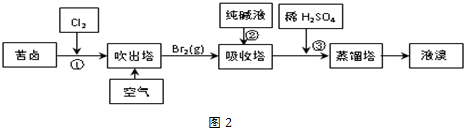
(3)①吸收塔中碳酸根离子与溴单质反应生成溴离子、硝酸根离子和二氧化碳气体,据此写出反应的离子方程式;
②在①中溴单质浓度较小,通过吹出、吸收、酸化重新获得含Br2的溶液,可以富集溴,降低成本,溴单质易挥发,可用水蒸气或热空气吹出;
③温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来.
解答 解:(1)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,则气体B是二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)①阴离子交换膜只允许阴离子通过,阳离子交换膜只允许阳离子通过,在外加电场的作用下海水中的阴、阳离子分别透过阴膜和阳膜,从而使一个间隔室的海水淡化,而其相邻间隔室的海水浓缩,
故答案为:分别透过阴膜和阳膜;淡化;浓缩;
②海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,
故答案为:海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度变大,离子浓度变大的为浓水,所以浓水在B处排出,淡水在A处排出,
故答案为:淡水;
(3)①纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑,
故答案为:3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
②从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,溴单质易挥发,可用水蒸气或热空气吹出,
故答案为:富集溴;水蒸气或热空气;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,
故答案为:顺利将溴蒸出,同时防止水馏出.
点评 本题考查海水的综合利用、制纯碱、电渗析法淡化海水、从海水中提溴的原理等知识,题目难度中等,明确图片内涵、生成流程为解本题关键,(2)中海水不能直接通入到阴极室中,为易错点,培养了学生运用知识分析问题和解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| B. | 在食品中大量添加苯甲酸钠等防腐剂,延长其保质期 | |
| C. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| D. | 将聚氯乙烯制成食品保鲜膜和包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
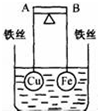 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
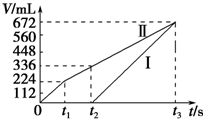 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
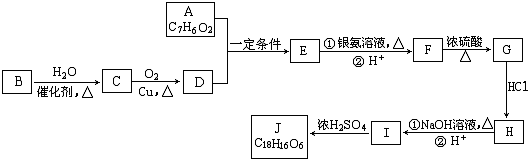
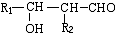
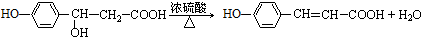 .
.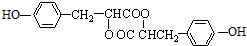 .
.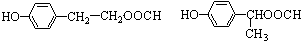 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com