
| A. | 氧化性酸:HNO3、H3PO4、HClO4 | |
| B. | 干燥剂:碱石灰、硅胶、无水氯化钙 | |
| C. | 酸性氧化物:SiO2、Cl2O、CrO3 | |
| D. | 危险化学品:天然气、金属钠、氯酸钾 |
分析 A.氧化性酸一般是含氧酸,是指酸中除了氢、氧元素之外的中心元素在化学反应中表现出强氧化性;
B.能够吸收气体中的水蒸气的物质做干燥剂;
C.和碱反应生成盐和水的氧化物为酸性氧化物;
D.危险化学品,是指具有毒害、腐蚀、爆炸、燃烧、助燃等性质,对人体、设施、环境具有危害的剧毒化学品和其他化学品;
解答 解:A.氧化性酸:HNO3、HClO4,H3PO4属于非氧化性酸,故A错误;
B.干燥剂是指能除去潮湿物质中水分的物质,碱石灰、硅胶、无水氯化钙都可以吸收水分,故B正确;
C.SiO2、Cl2O、CrO3 都能够和碱反应生成盐和水,分别生成硅酸盐、次氯酸盐、铬酸盐,属于酸性氧化物,故C正确;
D.天然气属于易燃气体、金属钠是活泼金属、氯酸钾易爆都属于危险化学品,故D正确;
故选A.
点评 本题考查了物质分类方法、物质性质的分析应用,注意知识的积累,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 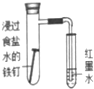 | 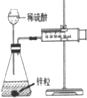 | 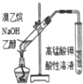 | 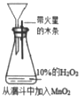 |
| 现象 | 导管中有红色柱 | 注射器的活塞往外推 | 高锰酸钾酸性溶液褪色 | 带火星的木条复燃 |
| 结论或作用 | 证明铁钉发生吸氧腐蚀 | 可用于测定反应物浓度对反应速率的影响 | 溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯 | MnO2可与H2O2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含4.5gAl | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 含有物质的量相等的(NH4)2SO4和MgCl2 | |
| D. | 含有MgCl2和FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
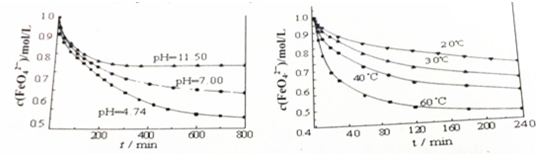
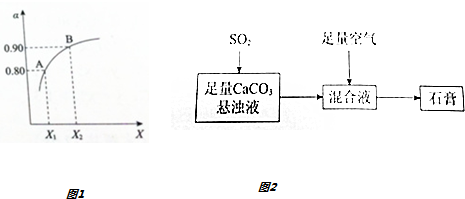
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在NaOH热溶液中完全水解后,加入热饱和食盐水可观察到液面上有固体析出 | |
| B. | 容量瓶、滴定管和分液漏斗均标有“O”刻度线,使用前均需要检漏 | |
| C. | 实验室用二氧化锰与浓盐酸制氯气时,先加热二氧化锰再滴加浓盐酸 | |
| D. | 为检验摩尔盐中的NH4+,可向试样加入少量的稀Na0H,再用pH试纸检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验开始时应先加热后通冷凝水 | |
| B. | 不能用湿润的pH试纸测定溶液的pH,否则必然会使实验结果产生误差 | |
| C. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)应过量 | |
| D. | 在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在量热剂中快速混合,并不断轻轻搅拌,测量混合液的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com