
为了测定酸碱反应的中和反应反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反 应前后溶液温度变化 ⑦操作所需的时间
应前后溶液温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑥ C.③④⑤⑥ D.全部
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色气体 | |
| B. | 常温常压下,NO不能与空气中的氧气直接化合 | |
| C. | 空气中的N2和O2在放电条件下可以发生反应生成NO | |
| D. | NO易溶于水,不能用排水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单键的键长最短,键能最大 | |
| B. | 叁键的键长最短,键能最大 | |
| C. | 双键中两个键都活泼,加成时都断裂 | |
| D. | 只有碳原子间才能形成双键和叁键 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
某固定体积的密闭容器中,加入一定量的A达化学平衡:aA(g) bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是( )
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是( )
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理来解释的是( )
A.往H2S水溶液中加碱有利于S2﹣增多
B.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率
C.高压有利于合成NH3的反应
D.500℃左右比室温更有利于合成NH3的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:实验题
同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
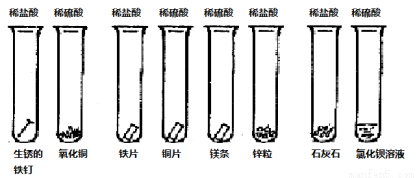
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(1)这8个实验是如何分组的?请写出各组的试管编号:第一组 第二组 第三组 ,你认为如此分组的依据是: 。
(2)写出试管②⑤的实验现象及有关的离子方程式:
② ;  。
。
⑤ ; 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①___________________________________;
②___________________________________;
③____________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
实验室欲配制6.00 mol·L-1的H2SO4溶液,现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸 ②150 mL 3.00 mol·L-1的硫酸 ③足量的18.00 mol·L-1的浓H2SO4。配制要求:①、②两种硫酸全部用完,不足部分由③补充。选用容量瓶的规格是( )
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列有关Na2CO3和NaHCO3性质的说法中,不正确的是
A.热稳定性:Na2CO3>NaHCO3
B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3
C.106 g Na2CO3和84 g NaHCO3分别与过量盐酸反应,放出CO2的质量相等
D.Na2CO3和NaHCO3均可与澄清石灰水反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
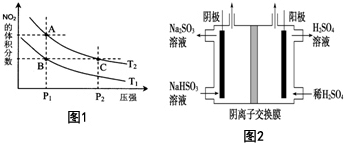 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com