
【题目】下列电离子方程式错误的是
A. NaHCO3=Na++HCO3- B. NaHSO4=Na++H++SO42-
C. H2SO4=2H++SO42- D. KClO3=K++Cl-+3O2-
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】将某溶液逐滴滴入Fe(OH)3胶体内。开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
A. 2 mol·L-1 H2SO4溶液 B. 2 mol·L-1 NaOH溶液
C. 2 mol·L-1 MgSO4溶液 D. 乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.芳香烃是指具有香味的有机化合物
B.含有苯环的有机物一定是芳香烃
C.芳香烃分子中一定含有苯环
D.含有一个苯环的芳香烃一定是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2↑+H2O
CH2===CH2↑+H2O
CH2===CH2+Br2→BrCH2CH2Br
可能存在的副反应有乙醇在浓硫酸存在下140℃时脱水生成乙醚。
用少量的溴和足量的乙醇反应制备1,2二溴乙烷的装置如图所示:

乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
请回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是________(填序号,下同)。
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)在装置C中应加入___________,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是____________________。
(4)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在________(填“上”或“下”)层。
(5)若产物中有少量未反应的Br2,最好用________洗涤除去。
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:

(1)B装置有三种功能:
①__________;②__________;③__________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值的取值范围为__________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_____________。
(4)E装置的作用是__________和________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,置换出黑色小颗粒的化学方程式为__________,可见有机反应有很多副反应。
(6)E装置除生成盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填编号)。
A.萃取法 B.蒸馏法
C.过滤法 D.分液法
该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是__________和________(填编号)。
A.CH4 B.CH3Cl
C.CH2Cl2 D.CHCl3
E.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率(A.变快 B.不变 C变慢,填字母代号);该反应向(填正移、逆移或不移).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 和
和 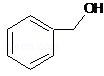 分子组成相差一个﹣CH2﹣,因此是同系物关系
分子组成相差一个﹣CH2﹣,因此是同系物关系
B.![]() 和
和 ![]() 均是芳香烃,
均是芳香烃, ![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C.分子式为C4H8的有机物可能存在4个C﹣C单键
D.分子式为C2H6O的红外光谱图上发现有C﹣H键和C﹣O键的振动吸收,由此可以初步推测:有机物结构简式一定为C2H5﹣OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定碘盐中KIO3的质量分数并制备少量KIO3 , 进行了如下实验. I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O; I2+2Na2S2O3=2Na I+Na 2S4O6
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c molL﹣1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有 .
(2)步骤三中到达滴定终点时的现象为 .
(3)实验测得此加碘盐中KIO3的质量分数 .
(4)Ⅱ.实验室制备KIO3已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.该化学小组通过以下装置制备KIO3 . 
装置A中反应的离子方程式为 .
(5)装置B中的试剂为 .
(6)写出装置C中生成KIO3的离子方程式 .
(7)上述实验装置存在一处明显缺陷,请指出 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AB2)=4.2×10﹣8 , Ksp(AC)=3.0×10﹣15 . 在AB2、AC均为饱和的混合液中,测得c(B﹣)=1.6×10﹣3 molL﹣1 , 则溶液中c(C2﹣)为( )
A.1.8×10﹣13 molL﹣1
B.7.3×10﹣13 molL﹣1
C.2.3 molL﹣1
D.3.7 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com