
| A. | 水泥 | B. | 氮化硅陶瓷 | C. | 磷酸钙陶瓷 | D. | 氧化铝陶瓷 |
分析 传统的无机非金属材料:如水泥、耐火材料、平板玻璃、仪器玻璃和普通的光学玻璃以及日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、搪瓷、磨料(碳化硅、氧化铝)、铸石、碳素材料、非金属矿(石棉、云母、大理石等).
新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等.
解答 解:A.水泥是传统无机非金属材料,不属于新型无机非金属材料,故A正确;
B.氮化硅陶瓷是新型无机非金属材料,故B错误;
C.磷酸钙陶瓷是新型无机非金属材料,故C错误;
D.氧化铝陶瓷是新型无机非金属材料,故D错误.
故选A.
点评 本题主要考查生活中常见的几种材料,难度不大,熟悉材料中的成分,能运用所学化学知识来解决实际问题.


科目:高中化学 来源: 题型:选择题
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加人Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、I-、Cl-、Ca2+ | |
| D. | 滴入紫色石蕊试液呈蓝色的溶液:Fe3+、Ba2+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
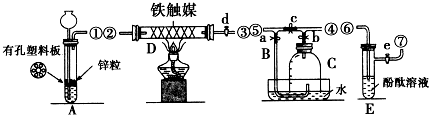
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
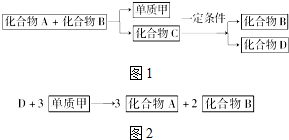 A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
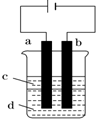 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: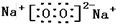 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com