
分析 (1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,以此判断计量数关系;
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,说明该反应前后气体体积不变;
(3)升高温度,平衡向吸热方向移动,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动.
解答 解:(1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=n mol:$\frac{n}{2}$mol:$\frac{3n}{2}$mol:n mol=2:1:3:2,
故答案为:2:1:3:2;
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;气体;
(3)升高温度,平衡向吸热方向移动;根据题意知,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放热.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力的考查,注意把握化学反应速率与化学计量数的关系,把握温度、压强对平衡移动的影响,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
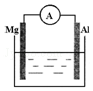 如图所示装置中,金属镁、铝和电流表通过导线相连:
如图所示装置中,金属镁、铝和电流表通过导线相连:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
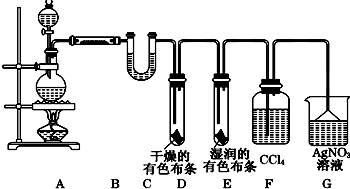
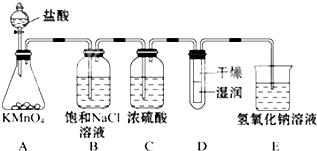 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: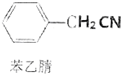 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$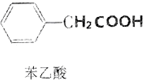 +NH4HSO4
+NH4HSO4查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com