
 .
.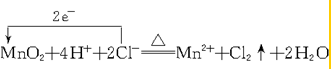 .
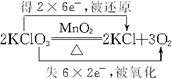
. 分析 (1)氯酸钾分解生成KCl和氧气,该反应中Cl元素化合价由+5价变为0价、O元素化合价由-2价变为0价,结合氧化还原反应的电子转移知识分析;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4价降低到+2价,Cl元素的化合价由-1价升高到0价,结合氧化还原反应的电子转移知识分析.
解答 解:(1)氯酸钾分解生成KCl和氧气,其反应的方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,该反应中Cl元素化合价由+5价变为0价,O元素化合价由-2价变为0价,转移的电子数目为: ;故答案为:
;故答案为: ;
;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mol2e-,改写成离子方程式以及用双线桥法表示反应中电子转移的数目为: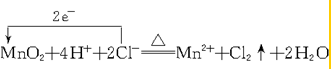 ,故答案为:
,故答案为: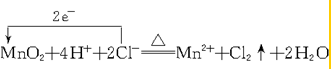 .
.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-═SO42-+H2O | |
| C. | Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质质量分数分别为a%和5a%的硫酸溶液按等体积混合,混合溶液中硫酸的质量分数大于3a% | |
| B. | 将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液 | |
| C. | 10mL质量分数14%的氨水,用水稀释至100mL,氨水的质量分数小于1.4% | |
| D. | 将w g a% NaCl溶液蒸发掉$\frac{w}{2}$ g水,得到4a% NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com