
某化学反应的能量变化如下图所示。下列有关叙述正确的是( )

A.该反应的反应热ΔH=E2-E1
B.a、b分别对应有催化剂和无催化剂的能量变化
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题.
 (1)化合物A的分子式是
(1)化合物A的分子式是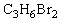 ,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
,A的氢核磁共振氢谱图如图所示,则A的结构简式为 。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。
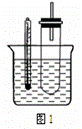
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是 。
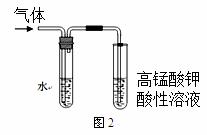
②图2是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是 ,水的作用是 ,实验现象是 。
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗? (填“需要”或“不需要”),理由是 。
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为 。
| 物质 | 熔点/℃ | 沸点/℃ |
| CH3CH2Br | -119 | 38 |
| BrCH2CH2Br | 9 | 131 |
| CH3CH2OH | -114 | 78 |
⑶已知:
分离溴乙烷与1,2-二溴乙烷混合气体的方法是 。
a.冰水浴冷却→过滤 b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液 d.水浴冷却→加水萃取→分液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一定温度下,有下列反应发生:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:
_____________________;
不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+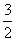 C(s)===
C(s)===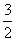 CO2(g)+2Fe(s)
CO2(g)+2Fe(s)
ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+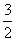 O2(g)===Fe2O3(s)的ΔH是____。
O2(g)===Fe2O3(s)的ΔH是____。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示0.1 mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )
A.c(Na+)>c(HCO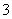 )>c(CO
)>c(CO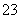 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO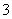 )+c(CO
)+c(CO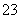 )+c(OH-)
)+c(OH-)
C.c(Na+)+c(H+)=c(HCO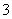 )+2c(CO
)+2c(CO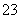 )+c(OH-)
)+c(OH-)
D.c(Na+)=c(HCO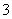 )+2c(CO
)+2c(CO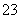 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O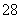 +2I-===2SO
+2I-===2SO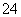 +I2 (慢)
+I2 (慢)
I2+2S2O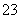 ===2I-+S4O
===2I-+S4O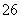 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O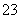 与S2O
与S2O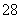 初始的物质的量需满足的关系为:n(S2O
初始的物质的量需满足的关系为:n(S2O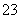 )∶n(S2O
)∶n(S2O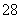 )________。
)________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=________,理由是________________________________________
___________________________________________________________________。
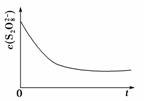
(3)已知某条件下,浓度c(S2O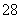 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O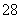 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=________;碘电极作为该电池的________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为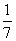
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关四个常用电化学装置的叙述正确的是( )


A.图Ⅰ所示电池中,MnO2作催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,浓度都为1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,4 s后X2、Y2、Z的浓度分别是0. 4 mol·L-1,0.8 mol·L-1,0.4 mol·L-1,如Z用X、Y表示,则该反应式是( )
A.X2+2Y2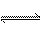 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2 2X2Y
2X2Y
C.3X2+Y2 2X3Y D.X2+3Y2
2X3Y D.X2+3Y2 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液的pH升高的原因是HCO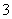 的水解程度增大,故碱性增强,该反应的离子方程式为__________________________。
的水解程度增大,故碱性增强,该反应的离子方程式为__________________________。
乙同学认为:溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度__________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)判断正确。试剂X是__________。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH__________(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言__________(填“甲”或“乙”)判断是错误的,理由是__________ _________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com