
| A. | NO3- | B. | Cl- | C. | CO32- | D. | SO32- |
分析 酸性溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应、相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.NO3-在溶液中离子之间不反应,可大量共存,故A选;
B.Ag+、Cl-结合生成沉淀,不能共存,故B不选;
C.Ba2+、Ca2+、Ag+均与CO32-结合生成沉淀,且氢离子与CO32-结合生成气体和水,不能共存,故C不选;
D.Ba2+、Ca2+、Ag+均与SO32-结合生成沉淀,且氢离子与SO32-结合生成气体和水,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8kJ•mol-1 | |
| C. | 对反应b来说,增大O2浓度可使△H2的值增大 | |
| D. | 以上两种途径,制取等量的氢气,无论哪种途径,消耗的能量均相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
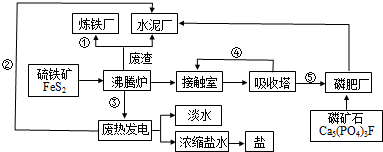
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
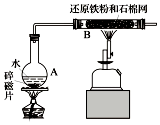 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com