
接触法制H2SO4的基本原理是:
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2+O2 ![]() 2SO3
2SO3
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析溶液的成分,并计算各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| x=n(SO2)/n(NaOH) | n(NaHSO3) |
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
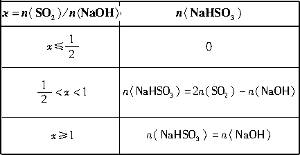
(1)设得CaSO4·2H2O的质量为y。
根据S元素守恒有:
SO2 ~ CaSO4·2H2O
22.4L 172g
104×103×0.2%L? y
y=153.6kg
(2)若溶质全为Na2SO3,则反应为
2NaOH+SO2 ![]() Na2SO3+H2O
Na2SO3+H2O
m(Na2SO3)=126g·mol-1×2×![]() mol=12.6g
mol=12.6g
若溶质全为NaHSO3,则根据反应
NaOH+SO2 ![]() NaHSO3
NaHSO3
m(NaHSO3)=104g·mol-1×2×0.1mol=20.8g
由于20.8>16.7>12.6,所以溶质为Na2SO3和NaHSO3的混合液。
设混合物中NaHSO3的物质的量为m,Na2SO3的物质的量为n。
解法一:
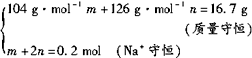
解之,得:m=0.1mol,?n=0.05mol
解法二:用配平方程式计算
(2n+m)NaOH+(m+n)SO2 ![]() nNa2SO3+mNaHSO3+nH2O
nNa2SO3+mNaHSO3+nH2O
则有
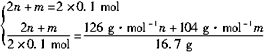
m=0.1mol n=0.05mol
(3)SO2通入NaOH溶液时可能发生的反?应为
2NaOH+SO2 ![]() Na2SO3+H2O(Ⅰ)
Na2SO3+H2O(Ⅰ)
NaOH+SO2 ![]() NaHSO3(Ⅱ)
NaHSO3(Ⅱ)
①当x=![]() ≤
≤![]() 时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。
时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。
②当x=![]() ≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
③当![]() <x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
<x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
n(NaHSO3)+2n(Na2SO3)=n(NaOH) (Na+守恒)
n(Na2SO3)+n(NaHSO3)=n(SO2) (S守恒)
解之,得n(NaHSO3)=2n(SO2)-n(NaOH)


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
A.硫酸厂应建在靠近原料产地的地区
B.接触法制H2SO4的主要步骤是造气、接触氧化和SO3的吸收
C.由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不需要采取高压的反应条件
D.工业三废的综合利用不仅能减少污染还可获得有用的副产品
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
![]()
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
x=n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.硫酸厂应建在靠近原料产地的地区
B.接触法制H2SO4的主要步骤是造气、接触氧化和SO3的吸收
C.由于常压下SO2转化为SO3的转化率很高,所以SO2接触氧化时不需要采取高压的反应条件
D.工业三废的综合利用不仅能减少污染还可获得有用的副产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com