
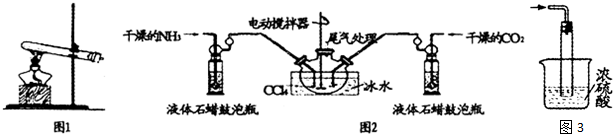
分析 (1)装置1是利用固体加热制取气体的装置,实验室常利用氯化铵和氢氧化钙加热制取氨气;
(2)①反应是放热反应降温平衡正向进行;液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解;
③氨基甲酸铵易水解,将浓H2SO4改为稀H2SO4,稀硫酸中水蒸气可能进入反应容器导致氨基甲酸铵水解;
(3)碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的质量分数.
解答 解:(1)装置1是利用固体加热制取气体的装置,铵盐和碱加热生成氨气,氢氧化钙与氯化铵加热反应生成氯化钙和氨气、水,则实验室制取氨气的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:氯化铵和氢氧化钙;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解;
液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,
故答案为:此反应为放热反应,降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);通过观察气泡,调节NH3与CO2通入比例;
②制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干;
故答案为:过滤;c;
③氨基甲酸铵易水解,浓硫酸可以防止水蒸气进入反应容器使氨基甲酸铵水解,但将浓H2SO4改为稀H2SO4,稀硫酸中水蒸气可能进入反应容器导致氨基甲酸铵水解,所以不能将浓H2SO4改为稀H2SO4,
故答案为:否;浓硫酸可以防止水蒸气进入反应容器使氨基甲酸铵水解(或者稀硫酸中水蒸气可能进入反应容器导致氨基甲酸铵水解);
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g.物质的量为$\frac{2.000g}{100g/mol}$=0.02mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,由碳元素守恒可知,
x+y=0.02 78x+79y=1.570g
解得x=0.01mol y=0.01mol
则样品中氨基甲酸铵的质量分数=$\frac{0.01mol×78g/mol}{1.570g}$×100%≈49.68%,
故答案为:49.68%.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.5% | B. | 60.6% | C. | 81.0% | D. | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com