
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |

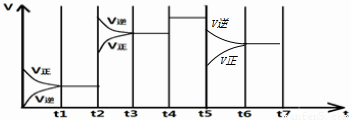
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
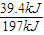 ×0.2mol=0.4mol,故二氧化硫的转化率为
×0.2mol=0.4mol,故二氧化硫的转化率为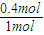 ×100%=40%.
×100%=40%.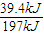 ×0.2mol=0.4mol,故二氧化硫的转化率为
×0.2mol=0.4mol,故二氧化硫的转化率为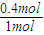 ×100%=40%,故X1<2X3=2X2<100%,故b错误;
×100%=40%,故X1<2X3=2X2<100%,故b错误;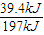 ×0.2mol=0.4mol,
×0.2mol=0.4mol,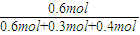 ×100%=46%,
×100%=46%,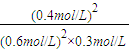 =1.5L?mol-1,
=1.5L?mol-1, ,
, ;
;

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
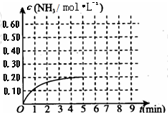 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:013
乙醇在一定条件下发生化学反应时,化学键断裂的位置如下所示,则乙醇在催化氧化时,化学键断裂的位置是
[ ]

|
A.②③ |
B.②④ |
|
C.①③ |
D.③④ |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)单质B的化学式________,电子式________。
(2)单质A和化合物乙发生反应的化学方程式_______,单质C和化合物丙发生反应 的化学方程式______________________。
(3)试根据化合物丙和丁中D元素的化合价判断丙和丁能否在一定条件下发生化学反 应生成D的单质,若能反应,写出相应的化学反应方程式;若不能反应,简要说明理 由。
查看答案和解析>>
科目:高中化学 来源: 题型:043
有A、B、C、D四种单质,在一定条件下,B可以和A、C、D化合生成甲、 乙、丙,C和D化合生成丁。已知甲、乙、丙的每个分子中均含有相等数目的电子,且甲、乙、丙、丁有下图所示关系,填写下列空白:

(1)单质B的化学式________,电子式________。
(2)单质A和化合物乙发生反应的化学方程式_______,单质C和化合物丙发生反应 的化学方程式______________________。
(3)试根据化合物丙和丁中D元素的化合价判断丙和丁能否在一定条件下发生化学反 应生成D的单质,若能反应,写出相应的化学反应方程式;若不能反应,简要说明理 由。
查看答案和解析>>
科目:高中化学 来源:新课程模块教与练·高中化学必修2(苏教版) 苏教版 题型:013
|
乙醇在一定条件下发生化学反应时,化学键断裂如图所示:
则乙醇在催化氧化时,化学键断裂的位置是 | |
| [ ] | |
A. |
②③ |
B. |
②④ |
C. |
①③ |
D. |
③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com