废旧物的回收利用既有利于节约资源,又有利于保护环境.某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO
4?7H
2O,含锰部分转化成纯度较高的MnO
2,将NH
4Cl溶液应用于化肥生产中,实验流程如下:
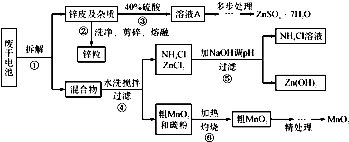
(1)操作②中所用的加热仪器应选
坩埚
坩埚
(填“蒸发皿”或“坩埚”).
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe
3+和Zn
2+ 沉淀,请写出氨水和Fe
3+反应的离子方程式:
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
.
(3)操作⑤是为了除去溶液中的Zn
2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb |
Zn 2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为
a
a
(填字母).
a.9 b.10 c.11
(4)MnO
2精处理的主要步骤:
步骤1:用3%H
2O
2和6.0mol?L
-1的H
2SO
4的混合液将粗MnO
2溶解,加热除去过量H
2O
2,得MnSO
4溶液(含少量Fe
3+ ).反应生成MnSO
4的离子方程式为
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
MnO2+H2O2+2H+=Mn2++2H2O+O2↑
.
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe
3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
吸附聚沉,有利于氢氧化铁形成较大沉淀颗粒
.
步骤3:向滤液中滴加0.5mol?L
-1的Na
2CO
3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO
2.灼烧过程中反应的化学方程式为
.
(5)查文献可知,粗MnO
2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO
3固体.
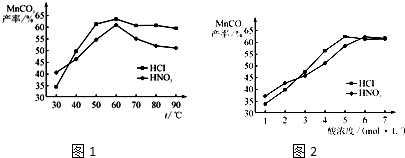
①在盐酸和硝酸溶液的浓度均为5mol?L
-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO
3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
60
60
℃左右.
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO
3产率的影响如图2,由图看出硝酸的最佳浓度应选择
6
6
mol?L
-1左右.