
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
【答案】(1)[Ar]3d9;N>O>S;(2)正四面体,CCl4(或SiF4等);(3)sp2,配位键、离子键;(4)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①(![]() ;
;![]() ;
;![]() ),Cu;②
),Cu;②![]() 。
。
【解析】
试题分析:(1)阳离子是Cu2+,Cu元素位于第四周期IB族,元素基态原子核外电子排布式为[Ar]3d104s1,因此Cu2+基态核外电子排布式为:[Ar]3d9;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,非金属性越强,第一电离能越大,即第一电离能大小顺序是N>O>S;(2)SO42-价层电子对数为SO42-价层电子对数为为4+(6+2-4×2)/20=4,因此SO42-立体结构是正四面体,等电子体:价电子总数相等,原子总数相等的微粒,因此S符合条件的是CCl4或SiF4等;(3)NO3-中N有3个σ键,孤电子对数(5+1-2×3)/2=0,杂化类型等于价层电子对数,即N的杂化类型为sp2,含有化学键为离子键、配位键;(4) CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高;(5)①根据各个原子的相对位置可知,D在各个方向的1/4处,所以其坐标是(![]() ;
;![]() ;
;![]() ),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=
),根据均摊法,白球的个数为(8×1/8+1)=2,灰球位于体心,灰球有4个,因此化学式为Cu2O,灰球是Cu;②晶胞质量为2×144/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,阿伏加德罗常数=![]() 。
。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
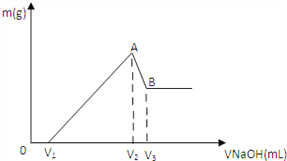
(1)写出A→B段反应的离子方程式_____________。
(2)A点沉淀的总物质的量n= _________________。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积为多少___________mL?(写出计算过程,下同)
(4)若V1=60mL,则混合物中Mg的物质的量为多少___________? V3点所加NaOH溶液的体积为多少___________mL?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al、Fe二种金属元素,下列说法正确的是
A. 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B. 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C. 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D. 二者的单质都能与强碱溶液反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a表示放热反应( )
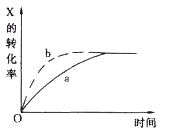
X(g)+Y(g)![]() Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量 C.加催化剂 D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是( )
A. 用25mL量筒量取12.36mL盐酸 B. 用托盘天平称量8.75g食盐
C. 用500mL容量瓶配制450mL溶液 D. 用广泛pH试纸测某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电子层结构相同的微粒,其化学性质—定相似
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 非金属元素的原子两两结合形成的化合物不一定是共价化合物
D. 元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Na2O2与SO3(g)的反应类似于Na2O2与CO2(g)的反应,请写出Na2O2与SO3反应的化学方程式:_____________________。
Ⅱ、某学生课外活动小组模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
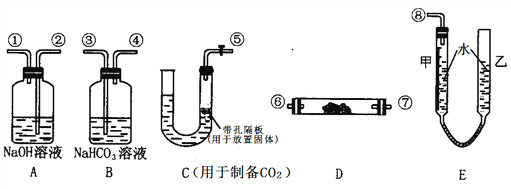
请回答下列问题:
(1)图中各装置接口连接顺序是_____________________(填各接口的编号,其中连接胶管及夹持装置均省略,):
→ → → ⑥ → ⑦ → → →
(2)装置D中发生反应的化学方程式为:_______________。
(3)装置B的作用是(用离子方程式表示):_______________。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,还应注意_______(填字母编号)。
a.视线与液体凹液面最低处相平才读数
b.等待气体恢复常温才读数
c.上下移动乙管,使甲乙两管液面相平才读数
(5)实验测得收集的氧气在标准状况下体积为V L,则参与反应的Na2O2 的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X2、Y2、Z2、W2四种物质的氧化能力W2>Z2>X2>Y2,下列氧化还原反应能发生的是
A.2NaW + Z2 = 2NaZ + W2 B.2NaW + X 2 = 2Na X + W2
C.2NaY + W2 = 2NaW + Y2 D.2NaZ + X2 = 2NaX + Z2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见化学物质的应用正确的是
A. 干冰能用作冷冻剂
B. 氯化钠可用作净水剂
C. 味精可用作食品调味剂
D. 小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com