
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的工艺如下:
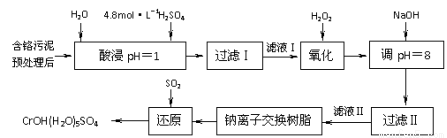
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、 。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式: 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
科目:高中化学 来源:2017届江西省高三上学期第二次段考化学试卷(解析版) 题型:实验题
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2•6H2O)的过程为:
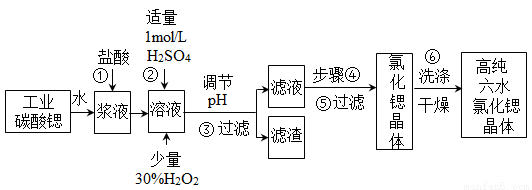
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。能否用新制氯水代替双氧水________(填“能”或“否”)。
(3)在步骤②~ ③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为_______。
③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为_______。
A.1.5 B.4 C.9.7 D.氧化钠
E氢氧化锶粉末 F碳酸钠晶体 G氧化锶粉末
(4)操作③中所得滤渣的主要成分是__________(填化学 式)。
式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是__________。
(6)步骤⑥中,洗涤氯化锶晶体最好选用___________。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
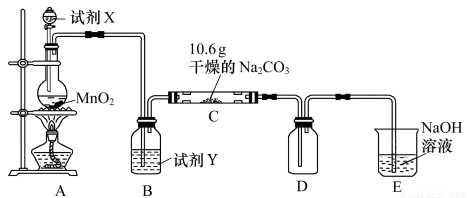
⑴写出装置A中发生反应的化学方程式: 。
⑵写出试剂Y的名称:__________________。
⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和_____________;
假设2:存在三种成分:NaHCO3、_____________和_____________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中 | — |
步骤2: | |
步骤3: |
⑷已知C中有0.1 mol Cl2参加反应。若假设1成立,可推知C中反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:推断题
【化学-选修5:有机化学基础】
G为合成抗脑损伤药物中间体,F能发生银镜反应。合成G的路线如下:
已知:
(1)烃A的名称为_______________;G中的官能团名称是_____________。
(2)D→E的化学反应方程式为____________________;F的结构简式为__________________。
(3)检验B中官能团的试剂为___________。
(4)满足下称条件的G的同分异构体有__________种。
①与氯化铁能发生显色反应 ②苯环上一氯代物只有一种 ③核磁共振氢谱只有五种吸收峰
(5)由G合成抗脑损伤药物L的合成路线如下:
H的结构简式为___________;②写出K的结构简式____________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO- 2+4NH+ 4+2H2O
B.少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+=4H2O+I2
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO- 3=3Fe3++NO↑+2H2O
D.碱性锌锰电池正极反应:2MnO2+2H2O+2e-=2MnOOH+2OH-
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是

A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.d点溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:填空题
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0kJ·mol-1和726.5 kJ·mol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________,石墨电极的质量是否发生变化 ___________ (填“是”或“否”)。
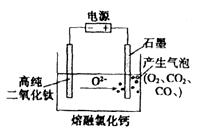
(3)常温下甲酸K=1×10-4。20.00mL0.1000mol·L-1NaOH溶液与一定量等物质的量浓度甲酸溶液混合后所得溶液中c(HCOOH)=c(HCOO-),该溶液c(H+)=________mol·L-1,所用甲酸的体积 ____40.00mL(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为________________。
(4)已知Ksp(BaSO4)=1.1×10-10,若向50.00 mL0.009 mol·L-1 Ba(NO3)2溶液中加入50.00 mL 0.010mol·L-1稀硫酸,混合后溶液中c(Ba2+)=_________ mol·L-1,pH=____________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是( )
A.氨碱法制碱 B.海带提碘 C.氯碱工业 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.Mg3N2晶体中的化学键是共价键
B.某物质含有离子键,则该物质在任何条件下均能导电
C.干冰是分子晶体,其气化过程中只需克服分子间作用力
D.常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com