
【题目】我们可以通过实验探究来研究化学反应速率的影响因素,
(1)为探讨反应物浓度对化学反应速率的影响,己知:
反应Ⅰ S2O82-+2I-=2SO42-+I2 (慢)反应Ⅱ I2+2S2O32-=2I-+S4O62-(快)
反应 S2O82-+ 2S2O32-= 2SO42-+ S4O62-的反应速率由______________决定(填“反应Ⅰ”、“反应Ⅱ”),I-是此反应的___________________________。
浓度c(S2O82-)反应时间t的变化曲线如下图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)t的变化曲线示意图(进行相应的标注)____________

(2)草酸与高锰酸钾在酸性条件下可以发生化学反应。请补全并配平下面方程式
______H2C2O3+ MnO4-+ =Mn2++CO2+
现有0.00lmol/L的酸性KMnO4溶液和0.0lmol/L的草酸溶液,为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | 温度/℃ | ||
KMnO4 溶液 | 水 | H2C2O4溶液 | ||
① | 4.0 | 0.0 | 2.0 | 25 |
② | 4.0 | 0.0 | 2.0 | 60 |
③ | 4.0 | Vx | 1.0 | 25 |
通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=_________mL,理由是_________________。
对比实验①、②的实验现象是___________________________________。
【答案】 反应Ⅰ 催化剂 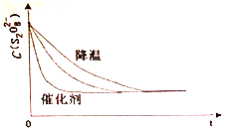 5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O 1.0 保证反应物草酸浓度改变,而其它的不变。 两实验中紫色溶液均褪色,但②褪色更快
5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O 1.0 保证反应物草酸浓度改变,而其它的不变。 两实验中紫色溶液均褪色,但②褪色更快
【解析】(1)反应Ⅰ、S2O82-+2I-=2SO42-+I2 (慢),反应Ⅱ、I2+2S2O32-=2I-+S4O62-(快),反应:S2O82-+ 2S2O32-= 2SO42-+ S4O62-的反应速率由反应Ⅰ决定,根据总反应可知,I-是此反应的催化剂;保持其它条件不变,降低温度,反应速率降低,到达平衡时溶液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达平衡时溶液颜色将由无色变成为蓝色的时间变短,因此图像为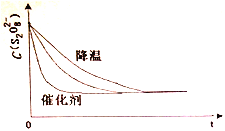 ,故答案为:反应Ⅰ;催化剂;
,故答案为:反应Ⅰ;催化剂;  ;
;
(2)草酸与高锰酸钾在酸性条件下可以发生化学反应生成锰离子、二氧化碳和水,反应的离子方程式为:5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O;根据表格数据,通过实验①、③可探究草酸的浓度对反应速率的影响,需要保证溶液的总体积相同,才能保证反应物草酸浓度改变,而其它的不变,因此表中Vx=1.0mL,实验①的温度比实验②低,反应速率慢,故实验现象为两实验中紫色溶液均褪色,但②褪色更快,故答案为:5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O;1.0;保证反应物草酸浓度改变,而其它的不变;两实验中紫色溶液均褪色,但②褪色更快。


科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公安部发布法令:从2011年5月1日起,醉酒驾驶机动车将一律入刑。下列关于酒精的叙述错误的是
A.化学名称为乙醇B.易挥发C.常用作有机溶剂D.不能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_________________________________________.
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ·mol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ·mol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_________________________.
(5)已知:N2 (g)+2O2 (g)═2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=﹣543kJ/mol
![]() H2 (g)+
H2 (g)+![]() F2 (g)═HF (g)△H=﹣269kJ/mol
F2 (g)═HF (g)△H=﹣269kJ/mol
H2(g)+![]() O2(g)═H2O (g)△H=﹣242kJ/mol
O2(g)═H2O (g)△H=﹣242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:_________________________.
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.b 与a、c、d的数学关系式是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(1)处于平衡状态的时间段是 (填选项).
A t0~t1 B t1~t2 C t2~t3
D t3~t4 E t4~t5 F t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A 增大压强 B 减小压强 C 升高温度
D 降低温度 E 加催化剂 F 充入氮气
t1时刻 ;t3时刻 ;t4时刻 .
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 质量为44g B. 质量为88g C. 分子数为 6.02×1023 D. 有4 mol原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A.电流由O2所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B. 丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色
C. 甲苯中所有原子都处于同一平面
D. 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com