
| A. | 向氨水中滴入稀硫酸:H++OH-═H2O | |
| B. | 向硫酸铝溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3- | |
| D. | 向氯化铵的稀溶液中滴入少量的NaOH溶液:NH4++OH-═NH3•H2O |
分析 A.一水合氨为弱电解质,应保留化学式;
B.不符合反应客观事实,应生成氢氧化铝和硫酸铵;
C.向饱和氨水中通过量的CO2气体,反应生成碳氢铵;
D.向氯化铵的稀溶液中滴入少量的NaOH溶液,反应生成氯化钠和一水合氨.
解答 解:A.向氨水中滴入稀硫酸,离子方程式:NH3•H2O+OH-═H2O+NH4+,故A错误;
B.向硫酸铝溶液中滴入过量的氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.饱和氨水中通过量的CO2气体:NH3+H2O+CO2═NH4++HCO3-,故C正确;
D.向氯化铵的稀溶液中滴入少量的NaOH溶液,离子方程式:NH4++OH-═NH3•H2O,故D正确;
故选:CD.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应应遵循客观事实.


科目:高中化学 来源: 题型:选择题
| A. | 能自发进行的化学反应,一定是△H<0,△S>0 | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(0H)2(s)?M2+(aq)+2OH-(aq) Ksp=a;c(M2+)=bmol•L-1时,溶液的pH等于14+$\frac{1}{2}$lg($\frac{b}{a}$) | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定存在分子间作用力,不一定有共价键 | |
| B. | 元素的非金属性越强,其单质的活泼性越强 | |
| C. | 含有金属阳离子的晶体不一定是离子晶体,离子晶体中一定含金属阳离子 | |
| D. | 溶于水后可电离出能自由移动离子的晶体一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.
氮元素是地球上含量很丰富的一种元素,其单质和化合物对我们的环境和生命有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 钢铁发生吸氧腐蚀时,电子流动方向可用图甲示意图表示 | |
| B. | 钢铁水闸在发生吸氧腐蚀时,产生铁锈最多的位置在图乙d处 | |
| C. | 用牺牲阳极保护法保护钢铁水闸时,可用图丙所示装置示意 | |
| D. | 用外接电源阴极保护法保护钢铁水闸时,可用图丁所示装置示意 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
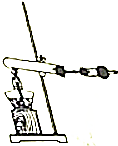
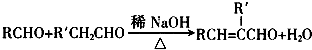 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)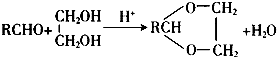
 .
.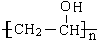 →
→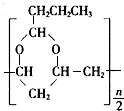 +$\frac{n}{2}$H2O.
+$\frac{n}{2}$H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com