某工厂排出的污水中含有大量的Fe
2+、Zn
2+、Hg
2+离子.以下是某学习小组的同学设计的除去上述金属离子,回收绿矾、皓矾(ZnSO
4?7H
2O)和汞的探究方案.
已知:K
SP(FeS)=6.3×10
-18mol
2?L
-2,K
SP(HgS)=6.4×10
-53mol
2?L
-2K
SP(ZnS)=1.6×10
-24mol
2?L
-2药品:NaOH溶液、Na
2S溶液、稀硫酸、铁粉 稀硝酸、稀盐酸
[实验方案]
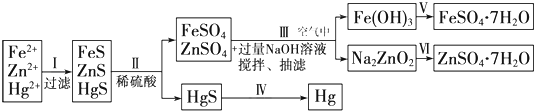
[问题探究]
(1)步骤Ⅰ中加入Na
2S溶液时,三种金属离子形成沉淀的先后顺序为
.
(2)步骤Ⅱ中FeS溶解的离子方程式:
.
(3)步骤Ⅲ中涉及反应的离子方程式 Zn
2++4OH
-═ZnO
+2H
2O和
.
(4)步骤Ⅲ和步骤Ⅵ发生的相关反应,说明Zn(OH)
2属于
_.
(5)欲实现步骤Ⅴ,需加入的试剂为
、
.步骤Ⅴ中从FeSO
4溶液浓缩结晶得到FeSO
4?7H
2O时,需加稀硫酸的原因是
.
(6)步骤Ⅳ常用的方法是加热法,但在空气中加热HgS 会污染环境,其原因可能
.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案