
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
分析 根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1molCO2通入2mol•L-1NaOH溶液1L中充分反应放出ykJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3(aq)+Na2CO3(aq)+H2O(l)△H=-4xkJ/mol①,
又1molCO2通入2mol•L-1NaOH溶液1L中充分反应,只生成Na2CO3,放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-ykJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)kJ/mol,
故选:C.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.


科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 | |
| C. | 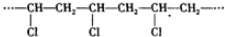 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 等质量的CH4、C2H4、C4H6分别在空气中充分燃烧,所耗用氧气的量依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 12 | C. | 16 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
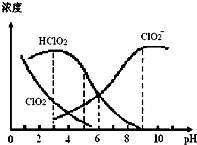 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可将稀硫酸改成浓硫酸 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气转化率增大 | |
| D. | 反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:Z>R>X>Y | |
| B. | 元素非金属性由强到弱的顺序:X>R | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X>Y | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、煤的液化、蛋白质的盐析、焰色反应都是化学变化 | |
| B. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 | |
| C. | 铅蓄电池是常见的二次电池.性能优良.比能量高.缺点是废弃电池污染严重 | |
| D. | 在新型催化剂条件下通过电力可将二氧化碳氧化为甲醇、甲烷等燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com