
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是 ( )
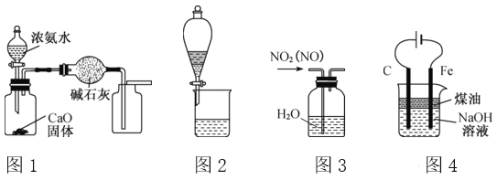
A. 用图1装置制取并收集干燥纯净的NH3
B. 用图2所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
C. 用图3所示装置可除去NO2中的NO
D. 用图4装置制备Fe(OH)2并能较长时间观察其颜色
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
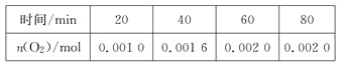
下列说法不正确的是( )
A. 前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B. 达到平衡时,需要从外界吸收的能量为0.968 kJ
C. 增大水的浓度,可以改变待反应的限度
D. 使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
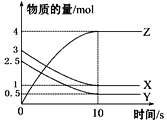
A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(单位皆为molL-1min-1)表示,则下列式子中,正确的是( )
A. 4v(O2)=5v(NO)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O)D. 4v(NH3)=5v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组进行如下实验:
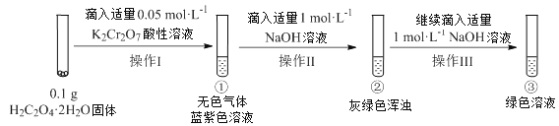
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32-、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:
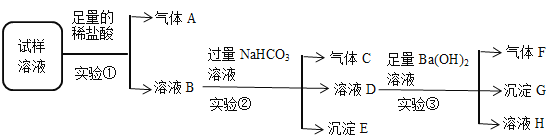
试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,气体A遇空气变成红棕色,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________________。(填离子符号)
(2)实验①中发生反应的离子方程式为_________________________________。
(3)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象______________________________。
II :汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(4)氧化还原法消除NOx的转化如下:
![]()
①反应I为NO+O3 = NO2+O2,生成标准状况11.2 L O2时,转移电子的物质的量是______mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________。
(5)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。
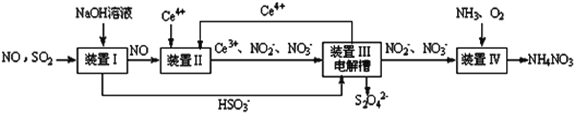
① 装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式________________
② 装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,同时在另一极生成S2O42-的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com