
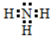 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑. 分析 X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,J为Na元素;Q的最外层电子数与其电子总数比为3:8,则Q应为第三周期的S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,X为H,Y2是空气的主要成分之一,Y为N元素,然后结合元素化合物知识来解答.
解答 解:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,J为Na元素;Q的最外层电子数与其电子总数比为3:8,则Q应为第三周期的S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,X为H,Y2是空气的主要成分之一,Y为N元素,
(1)Q元素在周期表中的位置为第三周期第VIA族,故答案为:第三周期第VIA族;
(2)电子层越多,原子半径越大,同周期原子序数大的原子半径小,则五种元素原子半径从大到小的顺序为Na>S>N>O>H,故答案为:Na>S>N>O>H;
(3)元素的非金属性Z>Q,则
A.Q的氢化物的水溶液放置在空气中会变浑浊,可知O得到电子能力强,能说明,故A不选;
B.Z与Q之间形成的化合物中元素的化合价中O为负价,O得到电子能力强,能说明,故B不选;
C.Z和Q的单质的状态不能比较非金属性,故C选;
D.Z和Q在周期表中的位置可知,同主族从上到下非金属性减弱,故D不选;
故答案为:>;C;
(4)X与Y可形成简单分子A为氨气,A的电子式为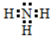 ,实验室制备气体A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
,实验室制备气体A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为: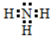 ;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素化合物知识、原子结构推断元素为解答的关键,侧重分析与推断、应用能力的考查,注意元素周期律、元素化合物知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的限度 | |
| B. | 决定反应速率的主要因素是反应物本身的性质 | |
| C. | 放热的反应在常温下不一定都很容易发生 | |
| D. | 放热反应还是吸热反应主要由反应物断键吸收能量与生成物成键放出能量的相对大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+CO32-+2H+═HCO3-+H2O | B. | 2OH-+CO32-+3H+═HCO3-+2H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g 甲烷中含有的原子数为NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 14 g乙烯和丙烯(它是乙烯的同系物,相对分子质量相差14)混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c的原子半径是这些元素中最大的 | |
| B. | b与其他三种元素均可形成至少两种二元化合物 | |
| C. | a与其他三种元素形成的二元化合物中其化合价均为+1 | |
| D. | d和a形成的化合物的溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新方法利用的是化学变化,旧方法利用的是物理变化 | |
| B. | 反应②中既有旧化学键的断裂又有新化学键的形成 | |
| C. | 在反应①中每生成 12g 金刚石需要消耗 46g 金属钠 | |
| D. | 反应①和反应②中所得的金刚石都是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
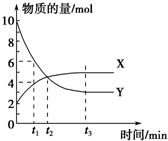 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
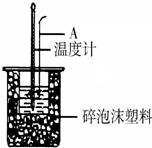 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com