
| A. | $\frac{12W}{n}$ | B. | $\frac{12n}{W}$ | C. | 6.02×1023W | D. | 12×6.02×1023W |
分析 一种原子的相对原子质量=$\frac{一个原子的真实质量}{\frac{一个C-12原子的真实质量}{12}}$,据此来分析;
一种物质的摩尔质量在数值上等于该物质的相当对分子质量,而单位物质的量的物质所具有的质量称为该物质的摩尔质量,据此分析.
解答 解:一种原子的相对原子质量=$\frac{一个原子的真实质量}{\frac{一个C-12原子的真实质量}{12}}$,故若某原子质量为wg.则该原子的相对原子质量=$\frac{wg}{\frac{ng}{12}}$=$\frac{12w}{n}$,故A正确,B错误;
若某原子质量为wg,则1mol该原子的质量m=6.02×1023wg,即该原子的摩尔质量为6.02×1023wg/mol,由于一种物质的摩尔质量在数值上等于该物质的相当对分子质量,故该原子的相对原子质量为6.02×1023w,故C正确,D错误.
故选AC.
点评 本题考查了相对分子质量的两种求算方法,应注意公式和概念的灵活运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该烃的名称是2-乙基-1-丁烯 | |
| B. | 该烃与H2加成得到的烷烃的名称是3-甲基戊烷 | |
| C. | 该烃可使溴水褪色,但不能与溴发生取代反应 | |
| D. | 该烃与HCl加成得两种卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生产I2:IO3-+5I-+3H2O=3I2+6OH- | |
| B. | FeSO4溶液中加入酸性K2Cr2O7溶液:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ | |
| D. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
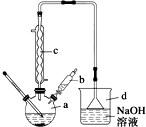 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com