
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
分析 (1)FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,溶液显酸性,再加入NaOH稀溶液,先发生中和反应,然后再反应生成氢氧化亚铁,生成二氧化硫排尽空气,氢氧化亚铁不被氧化为氢氧化铁;
(2)Fe(HSO3)2+被Fe3+氧化为SO42-,Fe3+被还原为Fe2+;
(3)步骤①、②中Fe3+被还原为Fe2+,加入K3[Fe(CN)6]得到Fe3(Fe(CN)6)2蓝色沉淀;
(4)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
解答 解:(1)FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,溶液显酸性,再加入NaOH稀溶液,先发生中和反应,然后再反应生成氢氧化亚铁,生成二氧化硫排尽空气,氢氧化亚铁不被氧化为氢氧化铁,现象为:开始无现象,然后产生白色沉淀,
故答案为:开始无现象,然后产生白色沉淀;
(2)Fe(HSO3)2+被Fe3+氧化为SO42-,Fe3+被还原为Fe2+,反应离子方程式为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+,
故答案为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(3)步骤①、②中Fe3+被还原为Fe2+,加入K3[Fe(CN)6]得到Fe3(Fe(CN)6)2蓝色沉淀,
故答案为:K3[Fe(CN)6];
(4)由步骤①可知,升高温度,反应速率加快,由步骤②可知提高FeCl3溶液的酸性会加快反应速率,
故答案为:升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
点评 本题考查反应原理的探究实验,侧重考查学生对信息的获取与迁移运用能力,注意掌握铁离子、亚铁离子检验方法,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸应保存在棕色试剂瓶并置于阴凉处 | |
| B. | 氢氟酸不能装在玻璃瓶,应装在塑料瓶中 | |
| C. | NaOH溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 常温下浓硫酸和浓硝酸可以铁制槽罐车运输 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是两种不同的核素 | |
| D. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
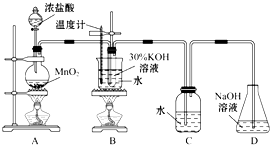 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com