
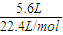 =0.25mol,转移电子的物质的量为0.25mol×4=1mol,则可向外提供1.6×104C的电量,故B错误;
=0.25mol,转移电子的物质的量为0.25mol×4=1mol,则可向外提供1.6×104C的电量,故B错误;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH====K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-==CO32-+7H2O
D.放电一段时间后,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.通过甲烷的电极为电池的负极,通过氧气的电极为正极 |
| B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 |
| C.通过甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O |
| D.放电一段时间后,溶液的pH升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com