
(15分)氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。请回答下列问题:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应探究脱氨原理。
①用适量0.1mol L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
②将KNO3溶液的pH调至2.5;
③向②调节pH后的KNO3溶液中持续通入一段时间N2,目的是 。
④用足量Fe粉还原③处理后的KNO3溶液。充分反应后,取少量反应液,加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,请根据以上信息写出Fe粉和KNO3溶液反应的离子方程式__。
(2)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中氧化剂与还原剂的物质的量之比为 。
(3)常温下向含0.01 mol HCl的溶液中缓缓通入224 mLNH3(标准状况,溶液体积变化忽略不计)。
①在通入NH3的过程中,溶液的导电能力 _________ (填“增强”、“减弱”或“基本不变”),理由是 ;水的电离程度 (填“增大”、“减小”或“基本不变”)。
②向HCl和NH3完全反应后的溶液中继续通入NH3,所得溶液中的离子浓度大小关系可能正确的是 (填字母编号)。
a.c(H+)>c(C1-)>c(OH-)>c(NH4+) b.c(NH4+)>c(C1-)>c(H+)>c(OH-)
c.c(NH4+)>c(H+)>c(C1-)>c(OH-) d.c(C1)=c(NH4+)>c(H+)=c(OH-)
(1)①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ②防止空气中的O2干扰反应
④4Fe+NO3-+10H+=4Fe2++NH4++3H2O (2)1:2
(3)①基本不变 溶液中的离子总浓度基本不变 增大 ②d
【解析】
试题分析:(1)①铁表面的氧化物主要是氧化铁,因此H2SO4可以除去Fe粉表面的氧化物是发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②氧气具有氧化性,而空气中含有大量的氧气,所以为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2;
④加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,该气体是氨气,说明溶液中含有铵盐,即硝酸根的还原产物是铵根,因此Fe粉和KNO3溶液反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(2)NH3与NaClO反应可得到肼(N2H4),反应中氮元素的化合价从-3价升高到-2价,失去1个电子,而次氯酸钠中氯元素的化合价从+1价降低到-1价,得到2个电子,因此根据电子得失守恒可知该反应中氧化剂与还原剂的物质的量之比为1:2;
(3)①氨气与盐酸反应生成氯化铵,由于氯离子浓度基本不变,因此在通入NH3的过程中,溶液的导电能力基本不变;由于氯化铵水解,因此水的电离程度增大;
②a.HCl和NH3完全反应后生成氯化铵,向溶液中继续通入NH3,氨气溶于水生成一水合氨,一水合氨是弱电解质,部分电离,因此溶液中c(NH4+)>c(OH-),a不正确;b.根据电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-)可知c(NH4+)>c(C1-)>c(H+)>c(OH-)不可能存在,b不正确;c.根据电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-)可知c(NH4+)>c(H+)>c(C1-)>c(OH-)不可能存在,c不正确;d.溶液可能显中性,因此c(C1)=c(NH4+)>c(H+)=c(OH-)可以存在,d正确,答案选d。
考点:考查实验条件控制、方程式书写、氧化还原反应计算、水的电离、盐类水解以及溶液中离子浓度大小比较等


科目:高中化学 来源:2013-2014广西贵港市毕业班5月高考冲刺模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放
B.汽油、柴油和植物油都是碳氢化合物
C.只由一种元素组成的物质,一定是纯净物
D.化学反应的实质就是旧化学键的断裂、新化学键形成过程
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
A.1 mol/L的AlCl3溶液 B.2mol/L的NaCl溶液
C.1.4mol/L的BaCl2溶液 D.1mol/L的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
符合下列情况的化学反应一定能自发进行的是
A. △H<0、△S>0 B. △H<0、△S<0
C. △H>0、△S<0 D. △H>0、△S>0
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是

A、电池放电时Na+从a极区移向b极区
B、每消耗6molH2O2转移电子6mol
C、电极a采用MnO2,MnO2既作电极又有催化作用
D、该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+
查看答案和解析>>
科目:高中化学 来源:2013-2014广东肇庆市毕业班第二次模拟考试理综化学试卷(解析版) 题型:实验题
.(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)2 | 7.0 | 9.0 |
Fe(OH)3 | 1.9 | 3.2 |
Cr(OH)3 | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如下图所示:
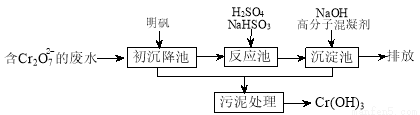
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
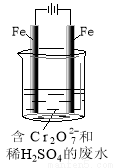
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com