
| A. | 1mol/L | B. | 2mol/L | C. | 3.2mol/L | D. | 4mol/L |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
→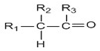
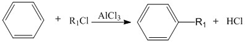
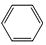 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$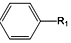 +HCl
+HCl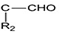 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: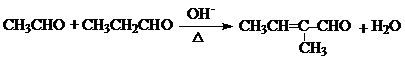 .
.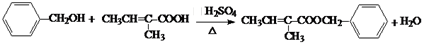 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
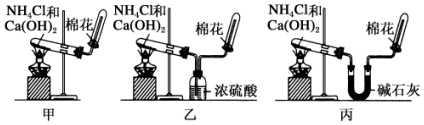
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com