
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
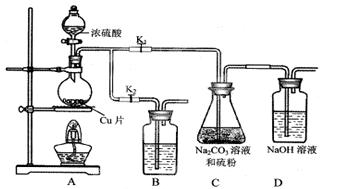
 CuSO4 + SO2↑ + 2H2O;
CuSO4 + SO2↑ + 2H2O; CuSO4 + SO2↑ + 2H2O。生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境。“停止C中的反应”的操作是打开K2,关闭K1。
CuSO4 + SO2↑ + 2H2O。生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境。“停止C中的反应”的操作是打开K2,关闭K1。 ,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是
,则根据反应的方程式可知,Na2S2O3·5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3·5H2O在产品中的质量分数是 。
。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源:不详 题型:填空题
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O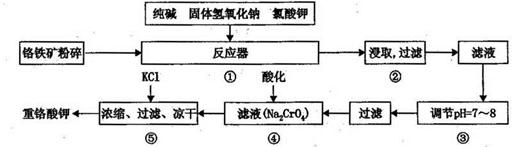
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
| B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C.测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量, |
| D.做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③④⑥ | B.②③⑥ | C.①②⑥ | D.④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2水置于棕色试剂瓶避光保存 | B.盛NaOH溶液的试剂瓶用磨口玻璃塞 |
| C.FeSO4溶液存放在加有少量铁粉的试剂瓶中 | D.金属钠存放于煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com