
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
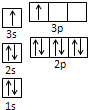
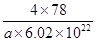 (3分)
(3分)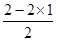 =0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
=0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。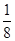 +6×
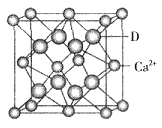
+6× =4,氟离子是8个,因此
=4,氟离子是8个,因此 ×6.02×1023=4,解得V=
×6.02×1023=4,解得V=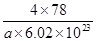 cm3。
cm3。

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:单选题
| A.SO3 |
| B.SO2 |
| C.Cl2 |
| D.NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔融态不导电 | B.水溶液呈中性 |
| C.熔点比BeBr2高 | D.不与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点是1070℃,易溶于水,水溶液能导电 |
| B.熔点是10.31℃,液态不导电,水溶液能导电 |
| C.能溶于水,熔点812.8℃,沸点是1446℃ |
| D.熔点是97.80℃,质软、导电,密度是0.97g/cm3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体中有阳离子就一定存在阴离子 |
| B.分子晶体中一定存在共价键和分子间作用力 |
| C.金属晶体的熔点一定比分子晶体高 |
| D.原子晶体中,一定只存在共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
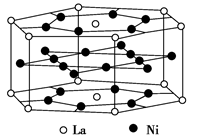
| A.LaNi5 | B.LaNi | C.La14Ni24 | D.La7Ni12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁能够被磁铁磁化 |
| B.铝常温下不溶于浓硝酸 |
| C.铜有良好的延展性、导热性和导电性 |
| D.钠与水剧烈反应放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com