
【题目】有关氨气的实验较多,对这些实验的实验原理的分析中,正确的是
A.氨气极易液化的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
D.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大,有关信息如下表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 地壳中含量位居第一位 |
Z | 短周期中,其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
请用对应元素的化学符号或化学式回答下列问题:
(1)X在周期表中的位置为_________;X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题.请写出该气态氢化物的电子式_________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法中正确的是________(填序号)。
a.原子半径:Rb>I
b.RbM中含有共价键
c.气态氢化物热稳定性:M>I
d.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料,其抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。可用Q的氧化物、焦炭和X的单质在高温下生成QX,已知每生成1mol QX,消耗18g碳,吸收a kJ的热量。据此,写出以上制取QX的热化学方程式__________。
(4)X、Y组成的一种无色气体遇空气变为红棕色,将一定量该无色气体与氧气通入水中,恰好被完全吸收,生成一种酸,请写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(C2H6O)的结构可能有两种:
(Ⅰ) (Ⅱ)
(Ⅱ)
关于确定其结构是(Ⅰ)而不是(Ⅱ)的方法,下列叙述中正确的是 ( )
A.1 mol乙醇与足量的钠作用生成0.5 mol H2B.乙醇具有挥发性
C.1 mol乙醇完全燃烧时生成3 mol水D.乙醇可以制酒精饮料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性KMnO4溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
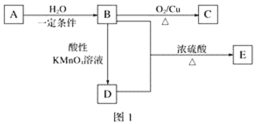

请回答下列问题:
(1)A的结构简式为___________,D中的官能团为_________。(写名称)
(2)A生成B的反应类型为__________________________
(3)由B生成C的反应方程式为______________________反应类型是__________。
(4)B与D反应生成E的化学方程式为______________________反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu4O(PO4)2是锂-磷酸氧铜电池正极的活性物质,它可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的电子排布式:_____。
(2)PO43-的空间构型是______。
(3)P、S、N元素第一电离能由大到小顺序为_____。
(4)氨基乙酸铜分子结构如下图,其中碳原子的杂化方式为____,基态碳原子核外电子有__种运动状态。

(5)晶胞原子坐标参数,表示晶胞内部各原子的相对位置,图1为铜与氧形成的某化合物晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0),则D原子的坐标参数为______。
,0),则D原子的坐标参数为______。
(6)图2为铜晶体中铜原子的堆积图,则晶体铜原子的堆积方式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
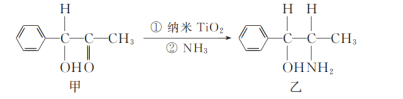
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
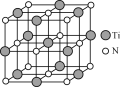
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com