
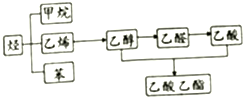
 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题:分析 (1)甲烷燃烧生成二氧化碳和水;
(2)乙烯和水在一定条件下发生加成反应生成乙醇;
(3)溴在苯中的溶解度大于在水中的溶解度,且水和苯不互溶;
(4)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯.
解答 解:(1)甲烷燃烧生成二氧化碳和水,反应方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
故答案为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(2)乙烯和水在一定条件下发生加成反应生成乙醇,该反应的反应类型是加成反应,故答案为:加成反应;
(3)溴在苯中的溶解度大于在水中的溶解度,且水和苯不互溶,所以苯符合萃取剂条件,则苯能萃取溴水中的溴,苯密度小于水,所以看到的现象是:溶液分层且下层为无色、上层为橙色,故答案为:分层且下层为无色、上层为橙色;
(4)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机化学反应方程式的书写、萃取、反应类型判断等知识点,明确物质结构及其性质关系是解本题关键,知道萃取剂的选取方法,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 钢铁在潮湿的空气中生锈 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 钢管被原油中的含硫化合物腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
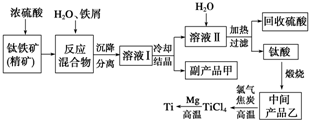 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z单质在放电条件下发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的6mol•L-1的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入数滴硝酸铜溶液 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com